安全性
投与24週時までの安全性
■投与24週時までの有害事象の概要(安全性解析対象集団)
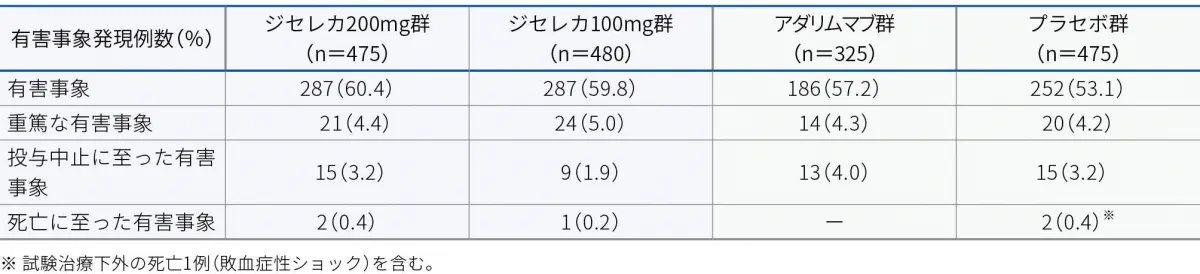
有害事象
投与24週時までの有害事象は、ジセレカ200mg群で60.4%(287/475例)、ジセレカ100mg群で59.8%(287/480例)、アダリムマブ群で57.2%(186/325例)、プラセボ群で53.1%(252/475例)に認められました。主な有害事象(2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎31例(6.5%)、上気道感染25例(5.3%)、悪心19例(4.0%)、高血圧16例(3.4%)、ALT増加13例(2.7%)、気管支炎12例(2.5%)、尿路感染11例(2.3%)、頭痛10例(2.1%)
- ジセレカ100mg群:上気道感染33例(6.9%)、上咽頭炎29例(6.0%)、貧血15例(3.1%)、ALT増加15例(3.1%)、AST増加14例(2.9%)、頭痛12例(2.5%)、リンパ球減少症10例(2.1%)、悪心10例(2.1%)、気管支炎10例(2.1%)
- アダリムマブ群:上気道感染17例(5.2%)、上咽頭炎15例(4.6%)、ALT増加14例(4.3%)、AST増加11例(3.4%)、頭痛10例(3.1%)、高血圧9例(2.8%)、気管支炎8例(2.5%)、尿路感染8例(2.5%)、下痢7例(2.2%)
- プラセボ群:上咽頭炎25例(5.3%)、RA 19例(4.0%)、頭痛17例(3.6%)、上気道感染14例(2.9%)、気管支炎14例(2.9%)、発熱13例(2.7%)、咽頭炎12例(2.5%)、貧血11例(2.3%)、ALT増加11例(2.3%)、咳嗽11例(2.3%)、関節痛10例(2.1%)
重篤な有害事象
投与24週時までの重篤な有害事象は、ジセレカ200mg群で4.4%(21/475例)、ジセレカ100mg群で5.0%(24/480例)、アダリムマブ群で4.3%(14/325例)、プラセボ群で4.2%(20/475例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:21例(肺炎3例、敗血性ショック、急性呼吸不全各2例、汎血球減少症、貧血、白内障、黄斑線維症、硝子体混濁、急性膵炎、腹痛、胃腸の炎症、腸出血、急性胆嚢炎、胆石症、気管支炎、四肢膿瘍、胃腸炎、爪囲炎、尿路感染、足関節部骨折、冠動脈再狭窄、大腿骨頚部骨折、ALT増加、リパーゼ増加、電解質失調、代謝性アシドーシス、急性腎障害、腎前性腎不全、肺塞栓症、肺水腫、低血圧各1例)
- ジセレカ100mg群:24例(肺炎2例、心筋梗塞、回転性めまい、胃炎、鼡径ヘルニア、口腔内潰瘍形成、閉塞性膵炎、口内炎、胸痛、胆嚢炎、蜂巣炎、カンジダ感染、丹毒、感染性皮膚潰瘍、骨髄炎、副鼻腔炎、歯膿瘍、水痘、大腿骨骨折、半月板損傷、低血糖、関節炎、筋力低下、子宮頚部癌第3期、浮動性めまい、一過性脳虚血発作、腎結石症、腎細胞異形成、不正子宮出血、腟出血、皮膚潰瘍各1例)
- アダリムマブ群:14例(肺炎2例、急性心筋梗塞、洞性頻脈、白内障、急性膵炎、蜂巣炎、感染性関節炎、ヘリコバクター感染、感染性腱鞘炎、ニューモシスチス・イロベチイ肺炎、細菌性肺炎、ALT増加、AST増加、膿疱性乾癬各1例)
- プラセボ群:20例(汎血球減少症、発熱性好中球減少症、急性心筋梗塞、心筋梗塞、白内障、膵炎、胆嚢炎、肺炎、気管支炎、感染性胸水、真菌性肺炎、肺炎球菌性肺炎、各種物質毒性、血中クレアチニン増加、足変形、四肢非対称、RA、乳癌第1期、悪性神経膠腫、前立腺癌、浮動性めまい、失神、器質化肺炎、声帯ポリープ、末梢動脈閉塞各1例)
投与中止に至った有害事象
投与24週時までの投与中止に至った有害事象は、ジセレカ200mg群で3.2%(15/475例)、ジセレカ100mg群で1.9%(9/480例)、アダリムマブ群で4.0%(13/325例)、プラセボ群で3.2%(15/475例)に認められました。投与中止に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:15例(肺炎2例、貧血、耳鳴、胃潰瘍、悪心、インフルエンザ様疾患、非アルコール性脂肪性肝疾患、四肢膿瘍、敗血症性ショック、ALT増加、γ-グルタミルトランスフェラーゼ増加、尿細管間質性腎炎、閉塞性気道障害、斑状丘疹状皮疹、高血圧各1例)
- ジセレカ100mg群:9例(肺炎2例、リンパ節症、骨髄炎、水痘、γ-グルタミルトランスフェラーゼ増加、関節痛、子宮頚部癌第3期、腟出血、皮膚潰瘍各1例)
- アダリムマブ群:13例(肺炎、ALT増加、AST増加各2例、洞性頻脈、インフルエンザ様疾患、注射部位過敏反応、感染性関節炎、ウイルス性肝炎、感染性腱鞘炎、ニューモシスチス・イロベチイ肺炎、細菌性肺炎、B型肝炎DNA測定陽性、結晶性関節障害、膿疱性乾癬各1例)
- プラセボ群:15例(肺炎、RA各2例、汎血球減少症、疾患進行、胃腸炎、肺炎球菌性肺炎、転倒、ALT増加、AST増加、高カリウム血症、低アルブミン血症、低マグネシウム血症、低ナトリウム血症、低リン酸血症、栄養障害、乳癌第1期、悪性神経膠腫、不眠症、急性腎障害、慢性腎臓病、尿管結石症、器質化肺炎、皮膚障害各1例)
死亡に至った有害事象
投与24週時までの死亡に至った有害事象は、ジセレカ200mg群で0.4%(2/475例)、ジセレカ100mg群で0.2%(1/480例)、プラセボ群で0.4%(2/475例)に認められました。死亡に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:2例(多区域性肺炎に続発する敗血症性ショック、敗血症性ショック各1例)
- ジセレカ100mg群:1例(心筋梗塞)
- プラセボ群:1例(抗生物質配合剤に対するアレルギー反応)、試験治療下外1例(敗血症性ショック)
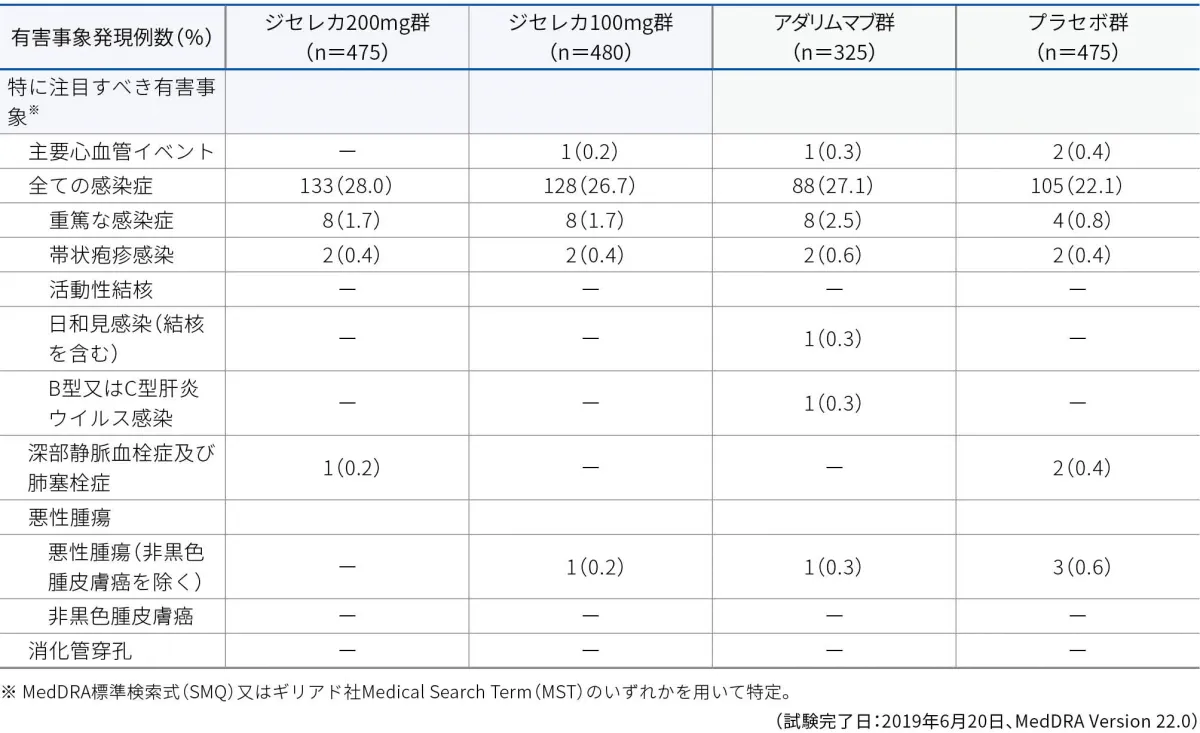
特に注目すべき有害事象※
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
■特に注目すべき有害事象
投与52週時までの安全性
■投与52週時までの有害事象の概要(安全性解析対象集団)
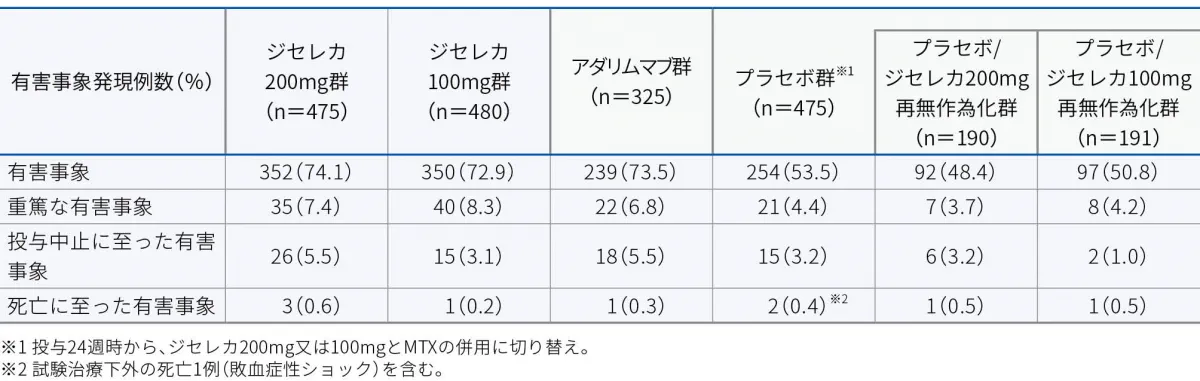
有害事象
本試験において、有害事象はジセレカ200mg群で74.1%(352/475例)、ジセレカ100mg群で72.9%(350/480例)、アダリムマブ群で73.5%(239/325例)、プラセボ群で53.5%(254/475例)、プラセボ/ジセレカ200mg群で48.4%(92/190例)、プラセボ/ジセレカ100mg群で50.8%(97/191例)に認められました。主な有害事象(2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎43例(9.1%)、上気道感染41例(8.6%)、悪心26例(5.5%)、高血圧22例(4.6%)、気管支炎21例(4.4%)、尿路感染19例(4.0%)、頭痛19例(4.0%)、ALT増加17例(3.6%)、貧血14例(2.9%)、白血球減少症14例(2.9%)、リンパ球減少症13例(2.7%)、嘔吐13例(2.7%)、AST増加12例(2.5%)、下痢12例(2.5%)、咽頭炎12例(2.5%)、インフルエンザ12例(2.5%)、腹痛12例(2.5%)、関節痛11例(2.3%)、浮動性めまい11例(2.3%)、背部痛10例(2.1%)
- ジセレカ100mg群:上気道感染49例(10.2%)、上咽頭炎48例(10.0%)、ALT増加25例(5.2%)、貧血23例(4.8%)、尿路感染20例(4.2%)、頭痛20例(4.2%)、気管支炎20例(4.2%)、AST増加20例(4.2%)、悪心16例(3.3%)、高血圧14例(2.9%)、リンパ球減少症14例(2.9%)、関節痛13例(2.7%)、咳嗽12例(2.5%)、便秘12例(2.5%)、白血球減少症11例(2.3%)、発熱10例(2.1%)、浮動性めまい10例(2.1%)、好中球減少症10例(2.1%)
- アダリムマブ群:上咽頭炎24例(7.4%)、ALT増加22例(6.8%)、上気道感染21例(6.5%)、AST増加18例(5.5%)、尿路感染17例(5.2%)、高血圧15例(4.6%)、頭痛13例(4.0%)、RA 11例(3.4%)、気管支炎10例(3.1%)、下痢10例(3.1%)、肺炎8例(2.5%)、関節痛7例(2.2%)、背部痛7例(2.2%)、上腹部痛7例(2.2%)、脱毛症7例(2.2%)
- プラセボ群:上咽頭炎25例(5.3%)、RA 19例(4.0%)、頭痛17例(3.6%)、上気道感染14例(2.9%)、気管支炎14例(2.9%)、発熱13例(2.7%)、咽頭炎12例(2.5%)、ALT増加11例(2.3%)、貧血11例(2.3%)、咳嗽11例(2.3%)、関節痛10例(2.1%)
- プラセボ/ジセレカ200mg群:尿路感染10例(5.3%)、上気道感染8例(4.2%)、AST増加8例(4.2%)、上咽頭炎7例(3.7%)、ALT増加7例(3.7%)、貧血5例(2.6%)、気管支炎4例(2.1%)、悪心4例(2.1%)、白血球減少症4例(2.1%)、胃腸炎4例(2.1%)
- プラセボ/ジセレカ100mg群:尿路感染8例(4.2%)、上咽頭炎6例(3.1%)、上気道感染6例(3.1%)、高血圧5例(2.6%)、咳嗽5例(2.6%)、気管支炎4例(2.1%)、リンパ球減少症4例(2.1%)
重篤な有害事象
本試験において、重篤な有害事象はジセレカ200mg群で7.4%(35/475例)、ジセレカ100mg群で8.3%(40/480例)、アダリムマブ群で6.8%(22/325例)、プラセボ群で4.4%(21/475例)、プラセボ/ジセレカ200mg群で3.7%(7/190例)、プラセボ/ジセレカ100mg群で4.2%(8/191例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:35例(肺炎4例、気管支炎、胆石症、急性呼吸不全、敗血症性ショック各2例、白内障、蜂巣炎、RA、急性腎障害、ALT増加、感染性関節炎、足変形、股関節部骨折、急性膵炎、汎血球減少症、肺塞栓症、皮膚潰瘍、尿路感染、腹痛、四肢膿瘍、胞隔炎、貧血、不安定狭心症、足関節部骨折、気管支拡張症、急性胆嚢炎、慢性肺性心、冠動脈再狭窄、穿孔性十二指腸潰瘍、電解質失調、大腿骨頚部骨折、胃腸炎、胃腸の炎症、ビタミン過剰症、低血圧、胃腸出血、リパーゼ増加、黄斑線維症、代謝性アシドーシス、肝転移、膵癌、爪囲炎、消化性潰瘍、ウイルス性肺炎、腎前性腎不全、肺線維症、肺水腫、呼吸不全、リウマチ肺、硝子体混濁、嘔吐各1例)
- ジセレカ100mg群:40例(肺炎4例、鼡径ヘルニア、一過性脳虚血発作各2例、蜂巣炎、胆石症、急性腎障害、胸痛、胆嚢炎、浮動性めまい、大腿骨骨折、椎間板障害、心筋梗塞、細菌性肺炎、皮膚潰瘍、失神、尿路感染、水痘、関節炎、カンジダ感染、子宮頚部癌第3期、大腸炎、冠動脈疾患、脱水、丹毒、胃炎、片麻痺、高血糖、感染性皮膚潰瘍、遠隔転移を伴う平滑筋肉腫、半月板損傷、不正子宮出血、口腔内潰瘍形成、筋力低下、腎結石症、閉塞性膵炎、骨髄炎、急性腎盂腎炎、腎細胞異形成、肩甲骨骨折、副鼻腔炎、口内炎、歯膿瘍、子宮出血、子宮平滑筋腫、腟出血、回転性めまい各1例)
- アダリムマブ群:22例(肺炎3例、白内障、蜂巣炎、急性心筋梗塞、ALT増加、感染性関節炎、深部静脈血栓症、股関節部骨折、椎間板障害、急性膵炎、細菌性肺炎、AST増加、乳癌、頚動脈狭窄、ヘリコバクター感染、感染性腱鞘炎、骨壊死、ニューモシスチス・イロベチイ肺炎、膿疱性乾癬、敗血症、洞性頻脈各1例)
- プラセボ群:21例(肺炎、気管支炎、白内障、RA、急性心筋梗塞、胆嚢炎、浮動性めまい、大腿骨骨折、足変形、心筋梗塞、汎血球減少症、失神、血中クレアチニン増加、乳癌第1期、発熱性好中球減少症、感染性胸水、四肢非対称、悪性神経膠腫、器質化肺炎、膵炎、末梢動脈閉塞、真菌性肺炎、肺炎球菌性肺炎、前立腺癌、各種物質毒性、声帯ポリープ各1例)
- プラセボ/ジセレカ200mg群:7例(肺炎、胸痛、深部静脈血栓症、虚血性脳卒中、肺塞栓症、血管浮腫、関節痛、皮膚炎、交通事故各1例)
- プラセボ/ジセレカ100mg群:8例(鼡径ヘルニア、RA、虚血性脳卒中、水痘、抑うつ気分を伴う適応障害、虫垂炎、メニエール病、前立腺炎各1例)
投与中止に至った有害事象
本試験において、投与中止に至った有害事象はジセレカ200mg群で5.5%(26/475例)、ジセレカ100mg群で3.1%(15/480例)、アダリムマブ群で5.5%(18/325例)、プラセボ群で3.2%(15/475例)、プラセボ/ジセレカ200mg群で3.2%(6/190例)、プラセボ/ジセレカ100mg群で1.0%(2/191例)に認められました。投与中止に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:26例(肺炎3例、ALT増加、感染性関節炎、慢性腎臓病、γ-グルタミルトランスフェラーゼ増加、インフルエンザ様疾患、四肢膿瘍、貧血、薬物性肝障害、穿孔性十二指腸潰瘍、胃潰瘍、B型肝炎、股関節部骨折、高血圧、肝転移、悪心、非アルコール性脂肪肝、閉塞性気道障害、膵癌、ウイルス性肺炎、斑状丘疹状皮疹、腎機能障害、敗血症性ショック、耳鳴、尿細管間質性腎炎、視覚障害各1例)
- ジセレカ100mg群:15例(肺炎4例、B型肝炎DNA測定陽性、帯状疱疹、γ-グルタミルトランスフェラーゼ増加、関節痛、子宮頚部癌第3期、片麻痺、リンパ節症、骨髄炎、皮膚壊死、皮膚潰瘍、腟出血、水痘各1例)
- アダリムマブ群:18例(肺炎、ALT増加、RA、AST増加各2例、B型肝炎DNA測定陽性、感染性関節炎、インフルエンザ様疾患、乳癌、結晶性関節障害、ウイルス性肝炎、感染性腱鞘炎、注射部位過敏反応、リンパ球数減少、ニューモシスチス・イロベチイ肺炎、細菌性肺炎、膿疱性乾癬、敗血症、洞性頻脈各1例)
- プラセボ群:15例(肺炎、RA各2例、ALT増加、AST増加、慢性腎臓病、急性腎障害、乳癌第1期、疾患進行、転倒、胃腸炎、高カリウム血症、低アルブミン血症、低マグネシウム血症、低ナトリウム血症、低リン酸血症、不眠症、悪性神経膠腫、栄養障害、器質化肺炎、汎血球減少症、肺炎球菌性肺炎、皮膚障害、尿管結石症各1例)
- プラセボ/ジセレカ200mg群:6例(帯状疱疹2例、肺炎、B型肝炎DNA増加、発熱、トランスアミナーゼ増加各1例)
- プラセボ/ジセレカ100mg群:2例(B型肝炎DNA測定陽性、心室性期外収縮各1例)
死亡に至った有害事象
本試験において、死亡に至った有害事象はジセレカ200mg群で0.6%(3/475例)、ジセレカ100mg群で0.2%(1/480例)、アダリムマブ群で0.3%(1/325例)、プラセボ群で0.4%(2/475例)、プラセボ/ジセレカ200mg群で0.5%(1/190例)、プラセボ/ジセレカ100mg群で0.5%(1/191例)に認められました。死亡に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:3例(多区域性肺炎に続発する敗血症性ショック、敗血症性ショック、胞隔炎各1例)
- ジセレカ100mg群:1例(心筋梗塞)
- アダリムマブ群:1例(敗血症)
- プラセボ群:1例(抗生物質配合剤に対するアレルギー反応)、試験治療下外1例(敗血症性ショック)
- プラセボ/ジセレカ200mg群:1例(急性深部静脈血栓症)
- プラセボ/ジセレカ100mg群:1例(水痘)
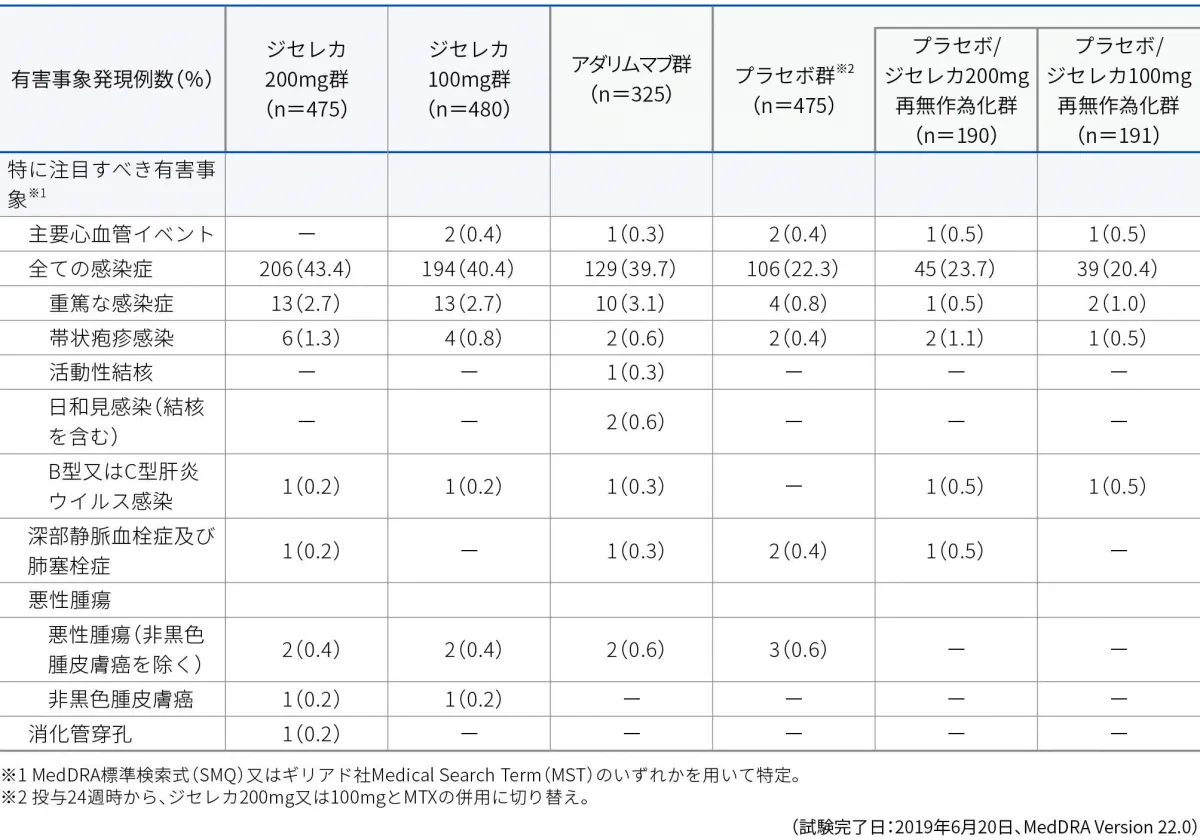
特に注目すべき有害事象※1
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
■特に注目すべき有害事象
日本人集団における安全性(サブグループ解析)
投与24週時までの安全性
■投与24週時までの有害事象の概要(日本人の安全性解析対象集団)
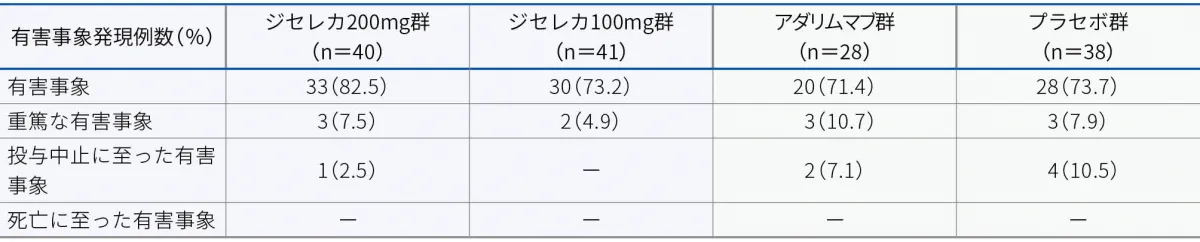
有害事象
日本人集団において、投与24週時までの有害事象は、ジセレカ200mg群で82.5%(33/40例)、ジセレカ100mg群で73.2%(30/41例)、アダリムマブ群で71.4%(20/28例)、プラセボ群で73.7%(28/38例)に認められました。主な有害事象(全体集団のいずれかの群で2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎7例(17.5%)、悪心4例(10.0%)、気管支炎4例(10.0%)、咽頭炎3例(7.5%)、下痢2例(5.0%)、頭痛2例(5.0%)、上気道感染1例(2.5%)、関節痛1例(2.5%)、咳嗽1例(2.5%)
- ジセレカ100mg群:悪心3例(7.3%)、上咽頭炎3例(7.3%)、下痢2例(4.9%)、上気道感染2例(4.9%)、ALT増加2例(4.9%)、頭痛2例(4.9%)、貧血1例(2.4%)、気管支炎1例(2.4%)、尿路感染1例(2.4%)、AST増加1例(2.4%)、RA 1例(2.4%)
- アダリムマブ群:上咽頭炎3例(10.7%)、発熱1例(3.6%)、上気道感染1例(3.6%)、RA 1例(3.6%)、関節痛1例(3.6%)、頭痛1例(3.6%)
- プラセボ群:上咽頭炎4例(10.5%)、咽頭炎3例(7.9%)、RA 3例(7.9%)、頭痛3例(7.9%)、発熱2例(5.3%)、下痢1例(2.6%)、上気道感染1例(2.6%)、気管支炎1例(2.6%)、尿路感染1例(2.6%)、咳嗽1例(2.6%)
重篤な有害事象
日本人集団において、投与24週時までの重篤な有害事象は、ジセレカ200mg群で7.5%(3/40例)、ジセレカ100mg群で4.9%(2/41例)、アダリムマブ群で10.7%(3/28例)、プラセボ群で7.9%(3/38例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:黄斑線維症1例(2.5%)、硝子体混濁1例(2.5%)、胃腸炎1例(2.5%)、冠動脈再狭窄1例(2.5%)
- ジセレカ100mg群:腎結石症1例(2.4%)、腎細胞異形成1例(2.4%)
- アダリムマブ群:肺炎1例(3.6%)、蜂巣炎1例(3.6%)、ニューモシスチス・イロベチイ肺炎1例(3.6%)
- プラセボ群:肺炎1例(2.6%)、肺炎球菌性肺炎1例(2.6%)、器質化肺炎1例(2.6%)
投与中止に至った有害事象
日本人集団において、投与24週時までの投与中止に至った有害事象は、ジセレカ200mg群で2.5%(1/40例)、アダリムマブ群で7.1%(2/28例)、プラセボ群で10.5%(4/38例)に認められました。投与中止に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:肺炎1例(2.5%)
- アダリムマブ群:肺炎1例(3.6%)、ニューモシスチス・イロベチイ肺炎1例(3.6%)
- プラセボ群:疾患進行1例(2.6%)、肺炎1例(2.6%)、肺炎球菌性肺炎1例(2.6%)、器質化肺炎1例(2.6%)
特に注目すべき有害事象※
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
日本人集団において、投与24週時までの特に注目すべき有害事象※は、以下のとおりでした。
- ジセレカ200mg群:全ての感染症19例(47.5%)、重篤な感染症1例(2.5%)、帯状疱疹感染1例(2.5%)
- ジセレカ100mg群:全ての感染症11例(26.8%)、帯状疱疹感染1例(2.4%)
- アダリムマブ群:全ての感染症8例(28.6%)、重篤な感染症3例(10.7%)、日和見感染(結核を含む)1例(3.6%)、悪性腫瘍(非黒色腫皮膚癌を除く)1例(3.6%)
- プラセボ群:全ての感染症13例(34.2%)、重篤な感染症2例(5.3%)
- MedDRA標準検索式(SMQ)又はギリアド社Medical Search Term(MST)のいずれかを用いて特定。
(試験完了日:2019年6月20日、MedDRA Version 22.0)
投与52週時までの安全性
■投与52週時までの有害事象の概要(日本人の安全性解析対象集団)
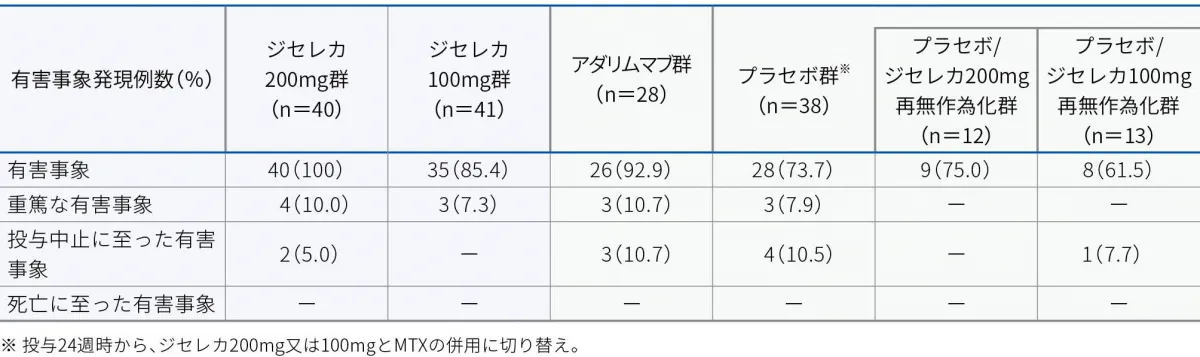
有害事象
本試験の日本人集団において、有害事象はジセレカ200mg群で100%(40/40例)、ジセレカ100mg群で85.4%(35/41例)、アダリムマブ群で92.9%(26/28例)、プラセボ群で73.7%(28/38例)、プラセボ/ジセレカ200mg群で75.0%(9/12例)、プラセボ/ジセレカ100mg群で61.5%(8/13例)に認められました。主な有害事象(全体集団のいずれかの群で2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎14例(35.0%)、インフルエンザ7例(17.5%)、気管支炎5例(12.5%)、頭痛4例(10.0%)、悪心4例(10.0%)、咽頭炎3例(7.5%)、浮動性めまい3例(7.5%)、上気道感染2例(5.0%)、高血圧2例(5.0%)、咳嗽2例(5.0%)、下痢2例(5.0%)、嘔吐2例(5.0%)、肺炎2例(5.0%)、腹痛2例(5.0%)、RA 1例(2.5%)、関節痛1例(2.5%)、白血球減少症1例(2.5%)、発熱1例(2.5%)、背部痛1例(2.5%)、胃腸炎1例(2.5%)、上腹部痛1例(2.5%)
- ジセレカ100mg群:上咽頭炎7例(17.1%)、悪心4例(9.8%)、インフルエンザ3例(7.3%)、浮動性めまい3例(7.3%)、上気道感染3例(7.3%)、ALT増加3例(7.3%)、気管支炎2例(4.9%)、頭痛2例(4.9%)、下痢2例(4.9%)、背部痛2例(4.9%)、AST増加2例(4.9%)、嘔吐1例(2.4%)、RA 1例(2.4%)、関節痛1例(2.4%)、尿路感染1例(2.4%)、貧血1例(2.4%)、便秘1例(2.4%)
- アダリムマブ群:RA 4例(14.3%)、上咽頭炎3例(10.7%)、インフルエンザ3例(10.7%)、背部痛2例(7.1%)、嘔吐2例(7.1%)、関節痛2例(7.1%)、上腹部痛2例(7.1%)、悪心1例(3.6%)、上気道感染1例(3.6%)、頭痛1例(3.6%)、便秘1例(3.6%)、咽頭炎1例(3.6%)、咳嗽1例(3.6%)、肺炎1例(3.6%)、発熱1例(3.6%)、好中球減少症1例(3.6%)
- プラセボ群:上咽頭炎4例(10.5%)、頭痛3例(7.9%)、RA 3例(7.9%)、咽頭炎3例(7.9%)、背部痛2例(5.3%)、肺炎2例(5.3%)、発熱2例(5.3%)、インフルエンザ1例(2.6%)、気管支炎1例(2.6%)、白血球減少症1例(2.6%)、上気道感染1例(2.6%)、咳嗽1例(2.6%)、下痢1例(2.6%)、尿路感染1例(2.6%)、胃腸炎1例(2.6%)
- プラセボ/ジセレカ200mg群:悪心2例(16.7%)、上咽頭炎1例(8.3%)、インフルエンザ1例(8.3%)、気管支炎1例(8.3%)、腹痛1例(8.3%)、白血球減少症1例(8.3%)
- プラセボ/ジセレカ100mg群:背部痛2例(15.4%)、頭痛2例(15.4%)、インフルエンザ1例(7.7%)、気管支炎1例(7.7%)、リンパ球減少症1例(7.7%)
重篤な有害事象
本試験の日本人集団において、重篤な有害事象はジセレカ200mg群で10.0%(4/40例)、ジセレカ100mg群で7.3%(3/41例)、アダリムマブ群で10.7%(3/28例)、プラセボ群で7.9%(3/38例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:4例(冠動脈再狭窄、穿孔性十二指腸潰瘍、胃腸炎、黄斑線維症、硝子体混濁各1例)
- ジセレカ100mg群:3例(細菌性肺炎、腎結石症、腎細胞異形成各1例)
- アダリムマブ群:3例(肺炎、蜂巣炎、ニューモシスチス・イロベチイ肺炎各1例)
- プラセボ群:3例(肺炎、器質化肺炎、肺炎球菌性肺炎各1例)
投与中止に至った有害事象
本試験の日本人集団において、投与中止に至った有害事象はジセレカ200mg群で5.0%(2/40例)、アダリムマブ群で10.7%(3/28例)、プラセボ群で10.5%(4/38例)、プラセボ/ジセレカ100mg群で7.7%(1/13例)に認められました。投与中止に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:2例(肺炎、穿孔性十二指腸潰瘍各1例)
- アダリムマブ群:3例(肺炎、RA、ニューモシスチス・イロベチイ肺炎各1例)
- プラセボ群:4例(肺炎、疾患進行、器質化肺炎、肺炎球菌性肺炎各1例)
- プラセボ/ジセレカ100mg群:1例(心室性期外収縮)
特に注目すべき有害事象※
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
本試験の日本人集団における特に注目すべき有害事象※は、以下のとおりでした。
- ジセレカ200mg群:全ての感染症29例(72.5%)、重篤な感染症1例(2.5%)、帯状疱疹感染1例(2.5%)、消化管穿孔1例(2.5%)
- ジセレカ100mg群:全ての感染症16例(39.0%)、重篤な感染症1例(2.4%)、帯状疱疹感染1例(2.4%)
- アダリムマブ群:全ての感染症13例(46.4%)、重篤な感染症3例(10.7%)、日和見感染(結核を含む)1例(3.6%)、悪性腫瘍(非黒色腫皮膚癌を除く)1例(3.6%)
- プラセボ群:全ての感染症13例(34.2%)、重篤な感染症2例(5.3%)
- プラセボ/ジセレカ200mg群:全ての感染症4例(33.3%)
- プラセボ/ジセレカ100mg群:全ての感染症3例(23.1%)
- MedDRA標準検索式(SMQ)又はギリアド社Medical Search Term(MST)のいずれかを用いて特定。
(試験完了日:2019年6月20日、MedDRA Version 22.0)
投与12週時のACR20改善率(主要評価項目〔検証的評価項目〕)ACR20/50/70改善率の推移(副次評価項目)
投与24週時のmTSSのベースラインからの変化量(主要評価項目〔検証的評価項目〕、追加された評価項目)投与52週時のmTSSのベースラインからの変化量(副次評価項目、追加された評価項目)
投与12週時及び投与24週時の低疾患活動性の各指標の達成率(副次評価項目、追加された評価項目)
投与24週時及び投与52週時の臨床的寛解の各指標の達成率(副次評価項目、追加された評価項目)
HAQ-DIスコアのベースラインからの変化量(副次評価項目)





