安全性
安全性
■有害事象の概要(安全性解析対象集団)
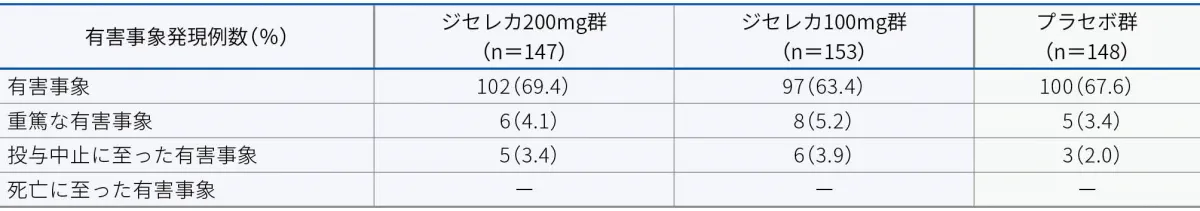
有害事象
本試験において、有害事象はジセレカ200mg群で69.4%(102/147例)、ジセレカ100mg群で63.4%(97/153例)、プラセボ群で67.6%(100/148例)に認められました。主な有害事象(2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎15例(10.2%)、上気道感染8例(5.4%)、気管支炎8例(5.4%)、頭痛8例(5.4%)、悪心7例(4.8%)、高血圧6例(4.1%)、インフルエンザ5例(3.4%)、下痢5例(3.4%)、関節痛5例(3.4%)、便秘5例(3.4%)、尿路感染4例(2.7%)、リンパ球減少症4例(2.7%)、脱毛症4例(2.7%)、胃食道逆流性疾患4例(2.7%)、回転性めまい4例(2.7%)、副鼻腔炎3例(2.0%)、嘔吐3例(2.0%)、不安3例(2.0%)、発熱3例(2.0%)、疲労3例(2.0%)、胃腸炎3例(2.0%)
- ジセレカ100mg群:上咽頭炎9例(5.9%)、上気道感染9例(5.9%)、頭痛9例(5.9%)、悪心8例(5.2%)、インフルエンザ6例(3.9%)、尿路感染6例(3.9%)、咽頭炎6例(3.9%)、高血圧5例(3.3%)、下痢4例(2.6%)、副鼻腔炎4例(2.6%)、消化不良4例(2.6%)、気管支炎3例(2.0%)、咳嗽3例(2.0%)、嘔吐3例(2.0%)、不安3例(2.0%)、浮動性めまい3例(2.0%)、季節性アレルギー3例(2.0%)、うつ病3例2.0%)、倦怠感3例(2.0%)
- プラセボ群:RA 9例(6.1%)、気管支炎8例(5.4%)、上咽頭炎7例(4.7%)、上気道感染6例(4.1%)、悪心6例(4.1%)、背部痛5例(3.4%)、発疹5例(3.4%)、貧血4例(2.7%)、咳嗽4例(2.7%)、インフルエンザ3例(2.0%)、下痢3例(2.0%)、関節痛3例(2.0%)、副鼻腔炎3例(2.0%)、上腹部痛3例(2.0%)、呼吸困難3例(2.0%)、低マグネシウム血症3例(2.0%)、筋骨格痛3例(2.0%)
重篤な有害事象
本試験において、重篤な有害事象はジセレカ200mg群で4.1%(6/147例)、ジセレカ100mg群で5.2%(8/153例)、プラセボ群で3.4%(5/148例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:6例(脱水、滑液包炎、蜂巣炎、脳振盪、下痢、裂傷、乳酸アシドーシス、肺水腫、肋骨骨折、子宮出血、回転性めまい各1例)
- ジセレカ100mg群:8例(口腔膿瘍、貧血、気管支炎、うつ病、胆嚢蓄膿、腰部脊柱管狭窄症、心筋虚血、骨炎、外陰部膿瘍各1例)
- プラセボ群:5例(胃腸炎2例、脱水、胸痛、呼吸困難、低ナトリウム血症、腰椎骨折、悪心、RA、くも膜下出血、全身性炎症反応症候群、嘔吐各1例)
投与中止に至った有害事象
本試験において、投与中止に至った有害事象はジセレカ200mg群で3.4%(5/147例)、ジセレカ100mg群で3.9%(6/153例)、プラセボ群で2.0%(3/148例)に認められました。投与中止に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:5例(血中アルカリホスファターゼ異常、気管支炎、胃食道逆流性疾患、しゃっくり、限局性感染、片頭痛各1例)
- ジセレカ100mg群:6例(不安、うつ病、帯状疱疹、ほてり、心筋虚血、骨炎、根管感染各1例)
- プラセボ群:3例(RA 2例、リンパ球数減少1例)
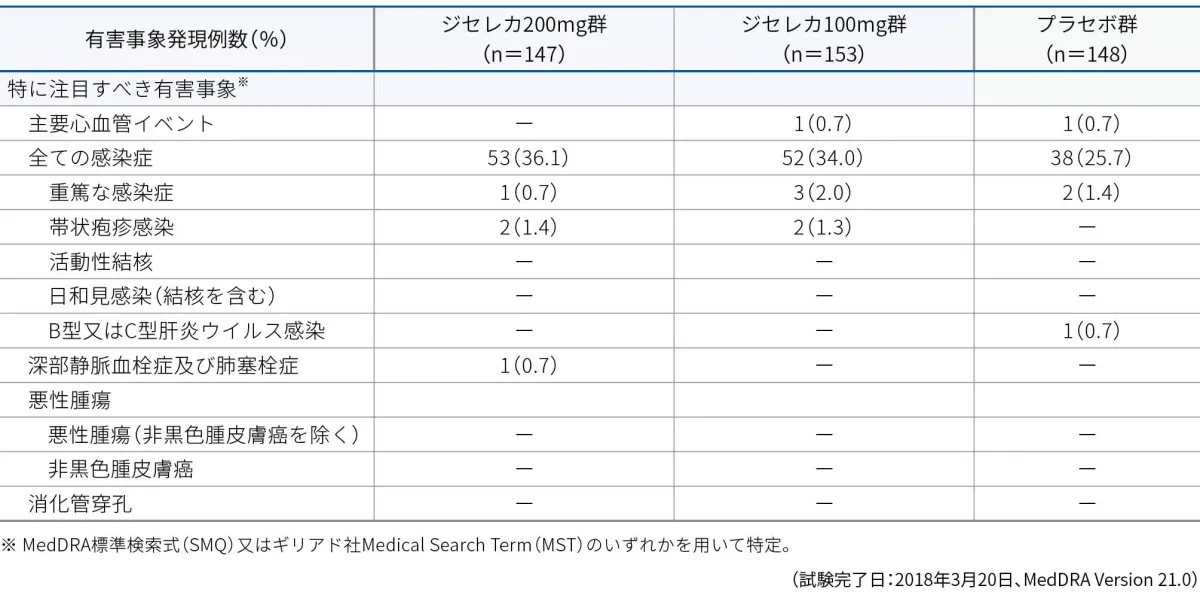
特に注目すべき有害事象※
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
■特に注目すべき有害事象
日本人集団における安全性(サブグループ解析)
■有害事象の概要(日本人の安全性解析対象集団)

有害事象
本試験の日本人集団において、有害事象はジセレカ200mg群で75.0%(9/12例)、ジセレカ100mg群で60.0%(9/15例)、プラセボ群で76.9%(10/13例)に認められました。主な有害事象(全体集団のいずれかの群で2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎4例(33.3%)、上気道感染1例(8.3%)、インフルエンザ1例(8.3%)、下痢1例(8.3%)、背部痛1例(8.3%)、咽頭炎1例(8.3%)、便秘1例(8.3%)、上腹部痛1例(8.3%)、浮動性めまい1例(8.3%)、季節性アレルギー1例(8.3%)、胃食道逆流性疾患1例(8.3%)
- ジセレカ100mg群:上咽頭炎2例(13.3%)、インフルエンザ2例(13.3%)、季節性アレルギー2例(13.3%)、上気道感染1例(6.7%)、下痢1例(6.7%)、咽頭炎1例(6.7%)、RA 1例(6.7%)、副鼻腔炎1例(6.7%)
- プラセボ群:RA3例(23.1%)、上咽頭炎2例(15.4%)、気管支炎1例(7.7%)
特に注目すべき有害事象※
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
本試験の日本人集団における特に注目すべき有害事象※は、以下のとおりでした。
- ジセレカ200mg群:全ての感染症6例(50.0%)、帯状疱疹感染1例(8.3%)
- ジセレカ100mg群:全ての感染症6例(40.0%)
- プラセボ群:全ての感染症4例(30.8%)
※ MedDRA標準検索式(SMQ)又はギリアド社Medical Search Term(MST)のいずれかを用いて特定。
(試験完了日:2018年3月20日、MedDRA Version 21.0)
投与12週時のACR20改善率(主要評価項目〔検証的評価項目〕)及びACR20/50/70改善率の推移(副次評価項目)
投与12週時及び投与24週時の低疾患活動性の各指標の達成率(副次評価項目、追加された評価項目)
投与12週時及び投与24週時の臨床的寛解の各指標の達成率(副次評価項目、追加された評価項目)
HAQ-DIスコアのベースラインからの変化量(副次評価項目)
bDMARDによる前治療の薬剤数別のジセレカの有効性(サブグループ解析)





