試験概要
一部承認外の成績が含まれますが、承認時評価資料のためご紹介します。
MTXで未治療な関節リウマチ患者における国際共同第Ⅲ相試験(FINCH3試験)1)
- 社内資料:FINCH 3[GS-US-417-0303]〔承認時評価資料〕
利益相反:本研究はGilead Sciences Inc.の支援を受けた。
利益相反:本研究はGilead Sciences Inc.の支援を受けた。
- 目的
- MTX未治療の中等度から重度の活動性RA患者を対象に、ジセレカ単独及びMTX併用下におけるジセレカ52週間投与の有効性と安全性を検討する。
- 対象
- MTX未治療の中等度から重度の活動性RA患者1,249例(うち日本人71例)。
- 主な選択基準
-
- ACR/EULARの2010年RA分類基準でRAと診断され、ACR機能分類Ⅰ~Ⅲに該当する18歳以上の男性又は女性
- スクリーニング時及びベースライン時に、SJC66が6以上及びTJC68が6以上
- スクリーニング時に①~③のパラメータの1つ以上に該当[①手、手首又は足のX線画像での1つ以上の関節びらんの確認、②RF又は抗CCP抗体が陽性(中央判定に基づく)、③高感度血清C反応性蛋白(hs-CRP)が4mg/L以上(中央判定に基づく)]
- 過去に受けたMTX投与が1回25mg以下※で3回以下、かつ最終投与がベースライン時の少なくとも28日前に行われ、治験責任医師によりMTX投与に適すると判断された
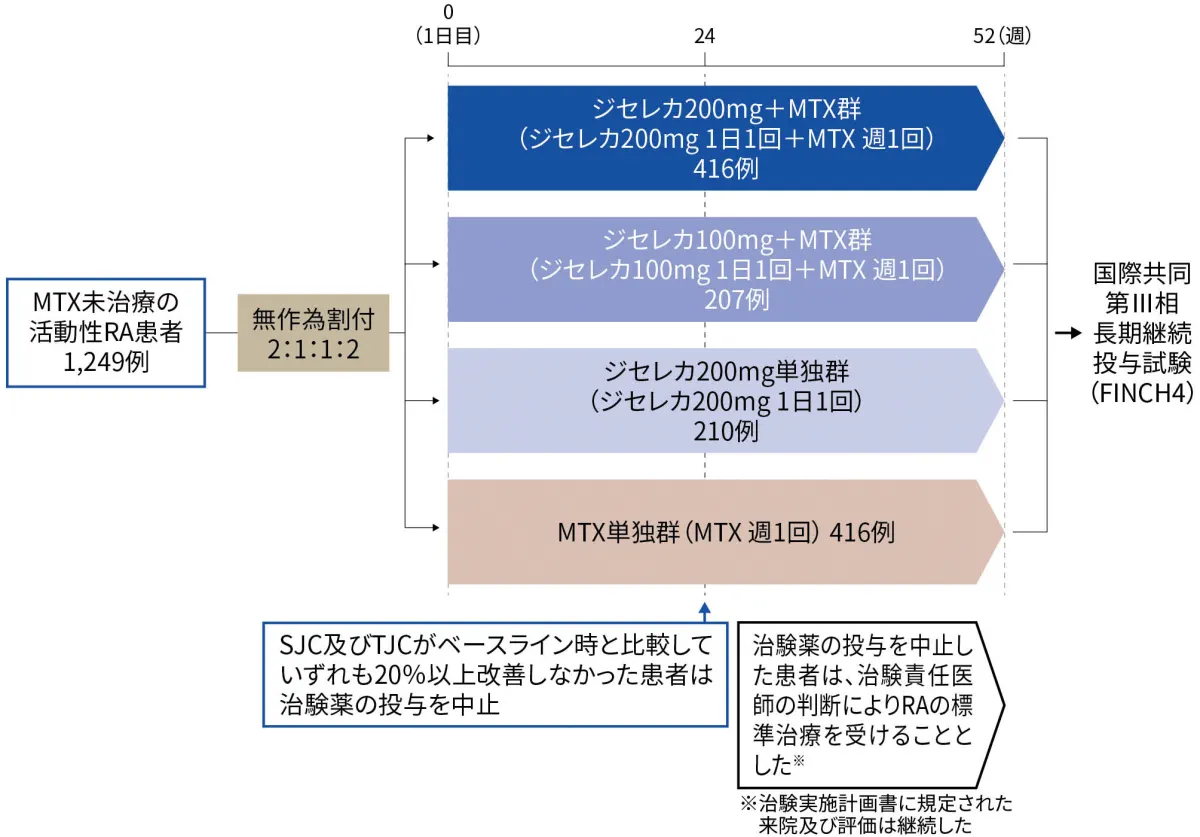
- 試験デザイン
- 国際共同第III相検証試験。多施設共同、無作為化、二重盲検、プラセボ及び実薬対照、並行群間比較試験。
地域、スクリーニング時のRF及び抗CCP抗体検出の有無による層別無作為化を実施した。 - 方法
- 対象をジセレカ200mg+MTX群、ジセレカ100mg+MTX群、ジセレカ200mg単独群又はMTX単独群に2:1:1:2の比率で無作為に割り付け、52週間投与した(ジセレカは各用量を1日1回経口投与、MTXは最大20mgを週1回経口投与※)。
投与24週時にSJC及びTJCがベースライン時と比較していずれも20%以上改善しなかった患者は治験薬の投与を中止し、RAの標準治療を受けることとした。 - <有効性評価項⽬>
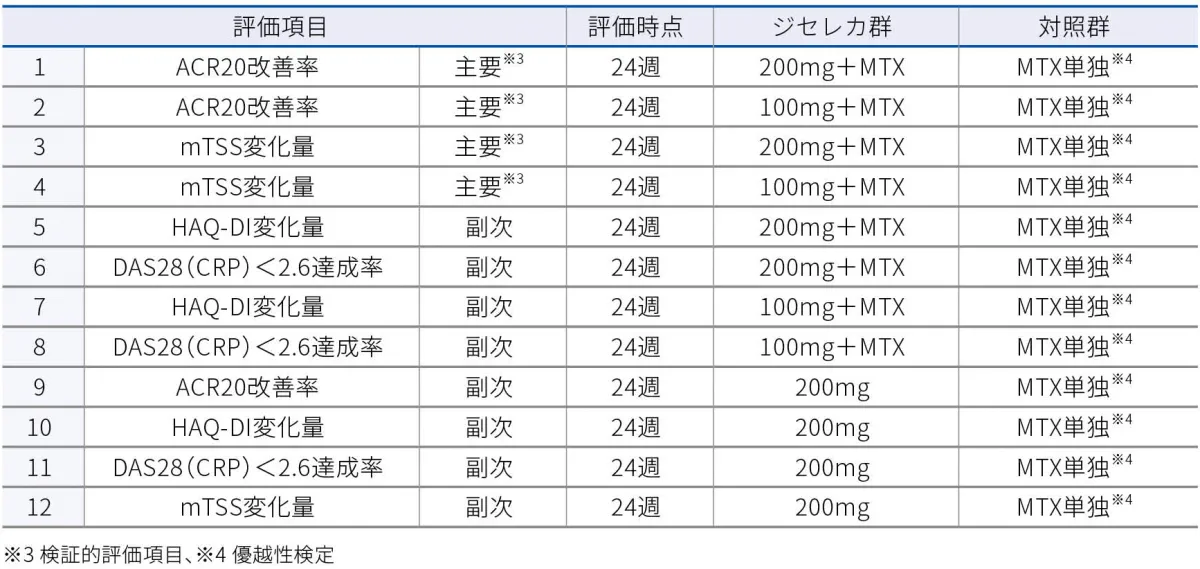
主要評価項目(検証的評価項⽬) -
- 投与24週時のACR20改善率(ジセレカ200mg+MTX群及びジセレカ100mg+MTX群とMTX単独群との⽐較)
- 投与24週時のmTSSのベースラインからの変化量(ジセレカ200mg+MTX群及びジセレカ100mg+MTX群とMTX単独群との⽐較)
- 副次評価項目
-
以下の項⽬を、ジセレカ200mg+MTX群、ジセレカ100mg+MTX群、ジセレカ200mg単独群、MTX単独群で検討した。
- 投与24週時のACR20改善率(ジセレカ200mg単独群とMTX単独群との⽐較)
- 投与1⽇⽬から52週時までのACR20改善率の推移(評価時点:投与1日目、投与2、4、8、12、16、20、30、36、44、52週時)
- 投与1⽇⽬から52週時までのACR50、ACR70改善率の推移(評価時点:投与1日目、投与2、4、8、12、16、20、24、30、36、44、52週時)
- 投与24週時のmTSSのベースラインからの変化量(ジセレカ200mg単独群とMTX単独群との⽐較)
- 投与52週時のmTSSのベースラインからの変化量
- 投与24、52週時のX線所見で進⾏がみられない(mTSSのベースラインからの変化量≦0)患者の割合
- 投与12、24週時のDAS28(CRP)≦3.2達成率
- 投与24、52週時のDAS28(CRP)<2.6達成率(投与24週時:ジセレカ200mg+MTX群、ジセレカ100mg+MTX群及びジセレカ200mg単独群とMTX単独群との⽐較)
- 投与24週時のHAQ-DIスコアのベースラインからの変化量(ジセレカ200mg+MTX群、ジセレカ100mg+MTX群及びジセレカ200mg単独群とMTX単独群との⽐較)
- 投与1⽇⽬から52週時までのHAQ-DIスコアのベースラインからの変化量の推移(評価時点:投与1日目、投与2、4、8、12、16、20、24、30、36、44、52週時)†
†ACRの個々の項⽬として評価
- 追加された評価項目※1
-
- 投与24、52週時のErosionスコア及びJSNスコア※2のベースラインからの変化量
- 投与12、24週時のSDAI≦11.0達成率、CDAI≦10.0達成率
- 投与24、52週時のSDAI≦3.3達成率、CDAI≦2.8達成率、Boolean基準による寛解達成率 ※1 承認申請過程においてPMDAの要請により追加し検討された。
※2 mTSSの構成要素 - <安全性評価項目>
-
- 有害事象(全投与期間及び投与24週時まで)
- 特に注⽬すべき有害事象として、本剤の薬理作⽤を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を⾏った。:主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、⽇和⾒感染、B型⼜はC型肝炎ウイルス感染、深部静脈⾎栓症及び肺塞栓症、悪性腫瘍(⾮黒⾊腫⽪膚癌を除く)、⾮黒⾊腫⽪膚癌、消化管穿孔
- 解析計画
-
- 全ての患者が投与24週時の来院を完了又は試験を早期に中止した後、計画されていた投与24週時の有効性の結果及び試験完了日(2019年5月8日)までに得られた安全性の結果を評価した。
- 有効性の解析はFAS、安全性の解析は安全性解析対象集団で実施した。
- 主要評価項目及び下表の副次評価項目は、JAPAN-SAPに基づいた階層的検定を実施し、多重性を調整した。
統計学的有意性(両側有意水準0.05)が認められた場合にのみ、次の項目の仮説検定を開始した。
帰無仮説が棄却されなかった場合は、正式な逐次検定を中止した。
※メトトレキサートの国内で承認された関節リウマチに対する用法及び用量
通常、1週間単位の投与量をメトトレキサートとして6mgとし、1週間単位の投与量を1回又は2~3回に分割して経口投与する。分割して投与する場合、初日から2日目にかけて12時間間隔で投与する。1回又は2回分割投与の場合は残りの6日間、3回分割投与の場合は残りの5日間は休薬する。
これを1週間ごとに繰り返す。なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減するが、1週間単位の投与量として16mgを超えないようにする。
4.効能又は効果
既存治療で効果不十分な関節リウマチ(関節の構造的損傷の防止を含む)
5.効能又は効果に関連する注意
5.1 過去の治療において、メトトレキサートをはじめとする少なくとも1剤の抗リウマチ薬等による適切な治療を行っても、疾患に起因する明らかな症状が残る場合に投与すること。
- 二値変数による有効性評価項目では、投与群及び層別因子をモデルに含めたロジスティック回帰分析を行い、p値及び正規近似に基づく95%CIを示した。欠測データはNRIとして取り扱った。連続データによる有効性評価項目では、ベースライン値、層別因子、投与群、来院及び投与群と来院の交互作用を固定効果、患者をランダム効果とするMMRMを用い、ベースラインからの平均変化量に関する差の最小二乗平均及び95%CIを示した。欠測データはMMRMを用いて処理した。
- 日本人集団における有効性及び安全性について全体集団と同様にサブグループ解析を実施した。
- ベースライン時に予後不良因子を有するRA患者※5における有効性(投与12、24、52週時のACR20改善率、ACR50改善率、ACR70改善率、投与24、52週時のDAS28(CRP)<2.6達成率、投与24、52週時のCDAI≦2.8達成率、投与24、52週時のBoolean基準による寛解達成率、投与24、52週時のmTSSベースラインからの変化量、投与12、24、52週時のHAQ-DIスコア低下≧0.22達成率)について探索的サブグループ解析を実施した※6。
※5 ベースライン時に①~④の全ての基準に該当した患者[①骨びらんの存在(骨びらんスコア>0)、②血清抗体陽性(RF又は抗CCP抗体が陽性)、③hs-CRP高値(≧4mg/L)、④高疾患活動性(DAS28(CRP)>5.1)]。
※6 承認申請過程においてPMDAの要請により追加し検討された。
■MTXで未治療なRA患者を対象とした国際共同第Ⅲ相試験:試験デザイン
4.効能又は効果
既存治療で効果不十分な関節リウマチ(関節の構造的損傷の防止を含む)
5.効能又は効果に関連する注意
5.1 過去の治療において、メトトレキサートをはじめとする少なくとも1剤の抗リウマチ薬等による適切な治療を行っても、疾患に起因する明らかな症状が残る場合に投与すること。
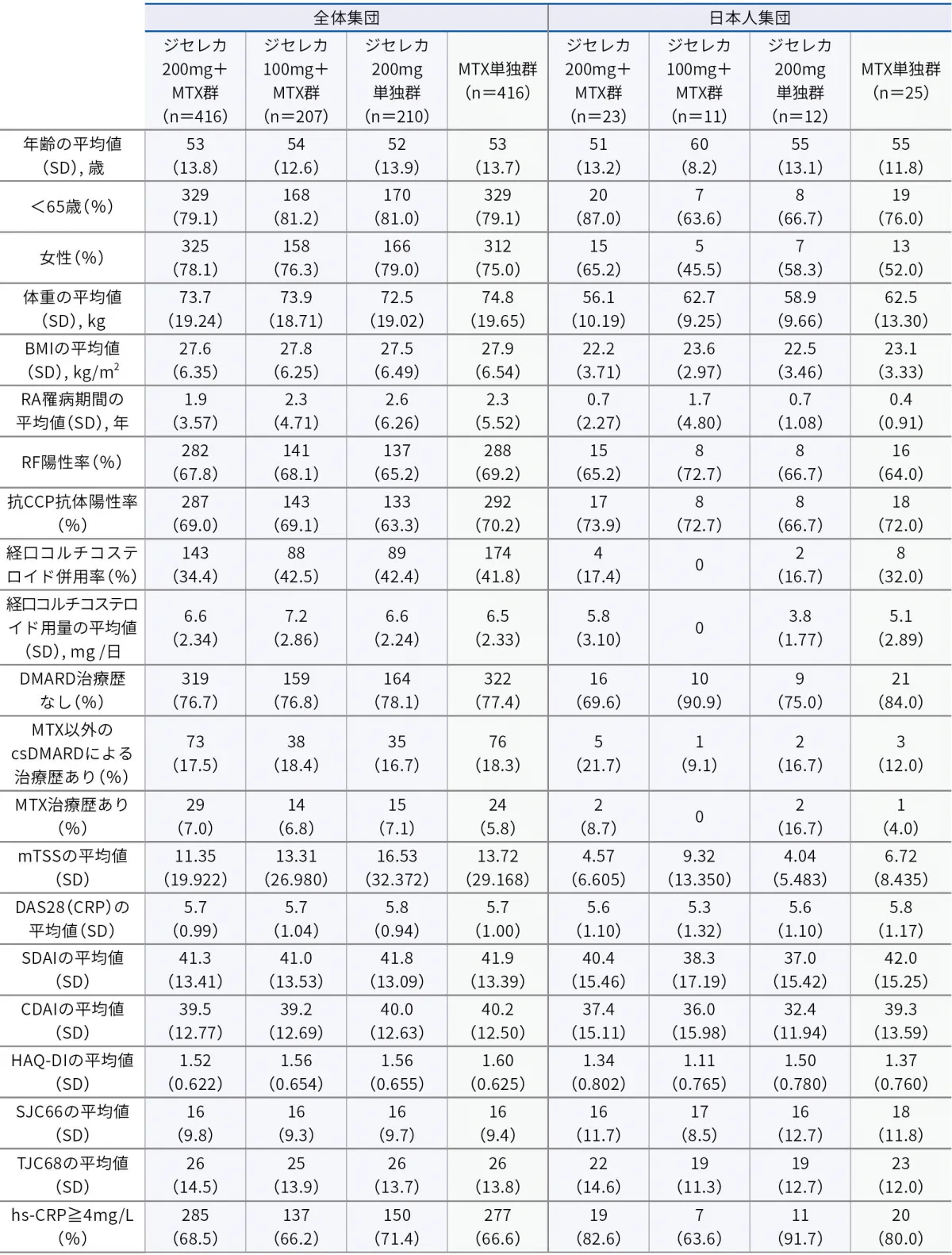
■患者背景(安全性解析対象集団:全体集団1,249例、日本人集団71例)
4. 効能又は効果
既存治療で効果不十分な関節リウマチ(関節の構造的損傷の防止を含む)
5. 効能又は効果に関連する注意
5.1 過去の治療において、メトトレキサートをはじめとする少なくとも1剤の抗リウマチ薬等による適切な治療を行っても、疾患に起因する明らかな症状が残る場合に投与すること。
投与24週時のACR20改善率(主要評価項目〔検証的評価項目〕、副次評価項目)ACR20/50/70改善率の推移(副次評価項目)
投与12週時及び投与24週時の低疾患活動性の各指標の達成率(副次評価項目、追加された評価項目)
投与24週時及び投与52週時の臨床的寛解の各指標の達成率(副次評価項目、追加された評価項目)
HAQ-DIスコアのベースラインからの変化量(副次評価項目)
予後不良因子を有するRA患者における有効性(探索的サブグループ解析)





