FINCH3試験の試験概要と有効性・安全性の結果
FINCH3試験は、MTX未治療の中等度から重度の活動性関節リウマチ患者を対象に、フィルゴチニブ単独およびMTX+フィルゴチニブ併用下で52週間治療した時の有効性と安全性を検討した国際共同第III相検証試験であり、多施設共同、無作為化、二重盲検、プラセボ及び実薬対照、並行群間比較試験です。
この動画では、北海道大学大学院医学研究院 免疫・代謝内科学教室教授 渥美達也先生に、FINCH3試験の概要および有効性・安全性の結果を解説していただきます。
この動画では、北海道大学大学院医学研究院 免疫・代謝内科学教室教授 渥美達也先生に、FINCH3試験の概要および有効性・安全性の結果を解説していただきます。
会員限定コンテンツ※再生するにはログインが必要です
FINCH3試験:試験概要
FINCH3試験は、MTX未治療の中等度から重度の活動性関節リウマチに対するジセレカ単独およびMTX併用下で52週間ジセレカを投与した時の有効性と安全性を検討しました。対象患者は1249例で、このうち71例が日本人でした。
FINCH3試験:試験デザイン
ジセレカ200mg+MTX群、ジセレカ100mg+MTX群、ジセレカ200mg単独群、MTX単独群に無作為に割り付け、52週まで投与しました。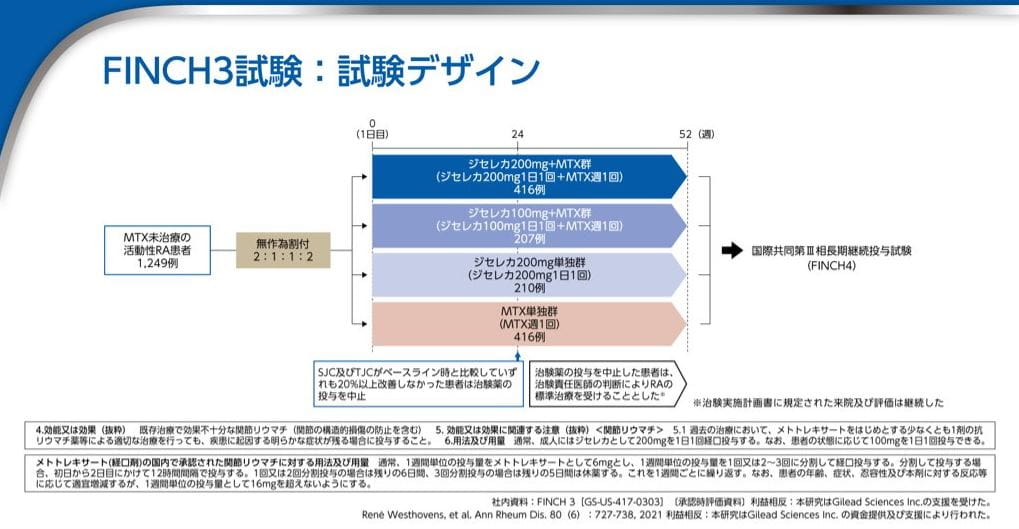
ondemand_video動画[46分31秒]
- 演者
- 北海道大学大学院医学研究院 免疫・代謝内科学教室教授
渥美 達也 先生
目次
試験概要
- 試験概要【00:00】
有効性
- 投与24週時のACR20改善率(主要評価項目〔検証的評価項目〕、副次評価項目)、投与24週時のmTSSのベースラインからの変化量(主要評価項目〔検証的評価項目〕、副次評価項目、追加された評価項目)【07:12】
- ACR20/50/70改善率の推移(副次評価項目)【09:06】
- 投与52週時のmTSSのベースラインからの変化量(副次評価項目、追加された評価項目)、投与24週時および投与52週時のX線所見で進行がみられない患者割合(副次評価項目) 【11:35】
- 投与12週時および投与24週時の低疾患活動性の各指標の達成率(副次評価項目、追加された評価項目)【13:31】
- 投与24週時および投与52週時の臨床的寛解の各指標の達成率 (副次評価項目、追加された評価項目)【15:11】
- HAQ-DIスコアのベースラインからの変化量(副次評価項目)【17:05】
- 予後不良因子を有するRA患者における有効性(探索的サブグループ解析)【17:56】
安全性
- 投与52週までの安全性 有害事象の概要【19:42】
- 投与52週までの安全性 主な有害事象【20:12】
- 投与52週までの安全性 重篤な有害事象【26:00】
- 投与52週までの安全性 投与中止に至った有害事象【30:34】
- 投与52週までの安全性 死亡に至った有害事象【34:14】
- 投与52週までの安全性 特に注目すべき有害事象【35:04】
- 日本人集団における安全性(サブグループ解析)有害事象の概要【37:52】
- 日本人集団における安全性(サブグループ解析)主な有害事象【38:40】
- 日本人集団における安全性(サブグループ解析)重篤な有害事象、投与中止に至った有害事象、死亡に至った有害事象【41:42】
- 日本人集団における安全性(サブグループ解析)特に注目すべき有害事象【44:25】
まとめ
- まとめ【45:56】





