試験概要
bDMARDで効果不十分又は不耐容な関節リウマチ患者における国際共同第Ⅲ相試験(FINCH2試験)1,2)
- 社内資料:FINCH 2[GS-US-417-0302]〔承認時評価資料〕
利益相反:本研究はGilead Sciences Inc.の支援を受けた。
- Genovese MC, et al. JAMA. 322(4):315-325, 2019
利益相反:本研究はGilead Sciences Inc. の資金提供及び支援により行われた。
本論文の著者には、Gilead Sciences Inc. の社員が含まれる。本論文の著者には、Gilead Sciences Inc.より講演料等を受領した者が含まれる。
利益相反:本研究はGilead Sciences Inc.の支援を受けた。
利益相反:本研究はGilead Sciences Inc. の資金提供及び支援により行われた。
本論文の著者には、Gilead Sciences Inc. の社員が含まれる。本論文の著者には、Gilead Sciences Inc.より講演料等を受領した者が含まれる。
- 目的
- 生物学的疾患修飾性抗リウマチ薬(bDMARD)で効果不十分又は不耐容な中等度から重度の活動性RA患者を対象に、従来型疾患修飾性抗リウマチ薬(csDMARD)併用下におけるジセレカ24週間投与の有効性と安全性を検討する。
- 対象
- bDMARDで効果不十分又は不耐容な中等度から重度の活動性RA患者448例(うち日本人40例)。
- 主な選択基準
-
- ACR/EULARの2010年RA分類基準でRAと診断された18歳以上(日本人は20歳以上)の男性又は妊娠中ではない女性
- スクリーニング時及びベースライン時に、SJC66が6以上及びTJC68が6以上
- スクリーニング時の臨床検査(中央測定)で、高感度血清C反応性蛋白(hs-CRP)が4mg/L以上
- MTX等のcsDMARD(1剤又は2剤)を一定の用量で投与を継続中※1
- 試験デザイン
- 国際共同第III相検証試験。多施設共同、無作為化、二重盲検、プラセボ対照、並行群間比較試験。
地域、前治療のbDMARDの数(3剤未満、3剤以上)、スクリーニング時のRF及び抗CCP抗体検出の有無による層別無作為化を実施した。 - 方法
- 対象をジセレカ200mg群、100mg群又はプラセボ群に1:1:1の比率で無作為に割り付け、1日1回、24週間経口投与した。
いずれの投与群もcsDMARDを一定の用量で併用投与した※1。投与14週時にSJC及びTJCがベースライン時と比較していずれも20%以上改善しなかった患者は治験薬の投与を中止し、RAの標準治療を受けることとした。 - メトトレキサート(MTX):通常、1週間単位の投与量をメトトレキサートとして6mgとし、1週間単位の投与量を1回又は2~3回に分割して経口投与する。分割して投与する場合、初日から2日目にかけて12時間間隔で投与する。1回又は2回分割投与の場合は残りの6日間、3回分割投与の場合は残りの5日間は休薬する。これを1週間ごとに繰り返す。なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減するが、1週間単位の投与量として16mgを超えないようにする。
- ヒドロキシクロロキン(国内未承認)
- サラゾスルファピリジン腸溶錠:本剤は、消炎鎮痛剤などで十分な効果が得られない場合に使用すること。通常、サラゾスルファピリジンとして成人1日投与量1gを朝食及び夕食後の2回に分割経口投与する。
- レフルノミド:通常、成人にはレフルノミドとして1日1回100mg錠1錠の3日間経口投与から開始し、その後、維持量として1日1回20mgを経口投与する。また、1日1回20mgの経口投与から開始することもできる。なお、維持量は、症状、体重により適宜1日1回10mgに減量する。
- <有効性評価項⽬>
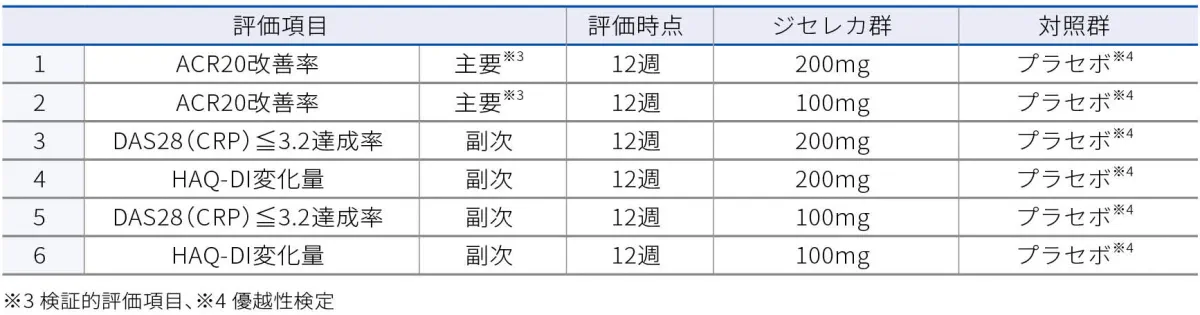
主要評価項目(検証的評価項⽬) -
- 投与12週時のACR20改善率(ジセレカ200mg群及びジセレカ100mg群とプラセボ群との⽐較)
- 副次評価項目
- 以下の項⽬を、ジセレカ200mg群、ジセレカ100mg群、プラセボ群で検討した。
- 投与1日目から24週時までのACR20改善率の推移(評価時点:投与1日目、投与2、4、8、14、16、20、24週時)
- 投与1日目から24週時までのACR50、ACR70改善率の推移(評価時点:投与1日目、投与2、4、8、12、14、16、20、24週時)
- 投与12、24週時のDAS28(CRP)≦3.2達成率(12週時はジセレカ200mg群及びジセレカ100mg群とプラセボ群との⽐較)
- 投与12、24週時のDAS28(CRP)<2.6達成率
- 投与12週時のHAQ-DIスコアのベースラインからの変化量(ジセレカ200mg群及びジセレカ100mg群とプラセボ群との⽐較)
- 投与1⽇⽬ から24週時までのHAQ-DIスコアのベースラインからの変化量の推移(評価時点:投与1日目、投与2、4、8、12、14、16、20、24週時)†
†ACRの個々の項目として評価
- 追加された評価項目※2
-
- 投与12、24週時のSDAI≦11.0達成率、CDAI≦10.0達成率、SDAI≦3.3達成率、CDAI≦2.8達成率、Boolean基準による寛解達成率 ※2 承認申請過程においてPMDAの要請により追加し検討された。
- <安全性評価項目>
-
- 有害事象(全投与期間)
- 特に注⽬すべき有害事象として、本剤の薬理作⽤を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を⾏った。:主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、⽇和⾒感染、B型⼜はC型肝炎ウイルス感染、深部静脈⾎栓症及び肺塞栓症、悪性腫瘍(⾮黒⾊腫⽪膚癌を除く)、⾮黒⾊腫⽪膚癌、消化管穿孔
- 解析計画
-
- 有効性の解析はFAS、安全性の解析は安全性解析対象集団で実施した。
- 主要評価項目及び下表の副次評価項目は、JAPAN-SAPに基づいた階層的検定を実施し、多重性を調整した。
統計学的有意性(両側有意水準0.05)が認められた場合にのみ、次の項目の仮説検定を開始した。
帰無仮説が棄却されなかった場合は、正式な逐次検定を中止した。
※1 csDMARDの各薬剤の国内で承認された関節リウマチに対する用法及び用量
- 二値変数による有効性評価項目では、投与群及び層別因子をモデルに含めたロジスティック回帰分析を行い、p値及び正規近似に基づく95%CIを示した。欠測データはNRIとして取り扱った。連続データによる有効性評価項目では、ベースライン値、層別因子、投与群、来院及び投与群と来院の交互作用を固定効果、患者をランダム効果とするMMRMを用い、ベースラインからの平均変化量に関する差の最小二乗平均及び95%CIを示した。欠測データはMMRMを用いて処理した。
- 日本人集団における有効性及び安全性について全体集団と同様にサブグループ解析を実施した(SF-36 MCSを除く)。
- 前治療のbDMARD数別(1剤、2剤、3剤以上)の有効性(投与12週時、投与24週時におけるACR20改善率、DAS28(CRP)≦3.2達成率及びDAS28(CRP)<2.6達成率)についてサブグループ解析を実施した。
■bDMARDで効果不十分又は不耐容なRA患者を対象とした国際共同第Ⅲ相試験:試験デザイン

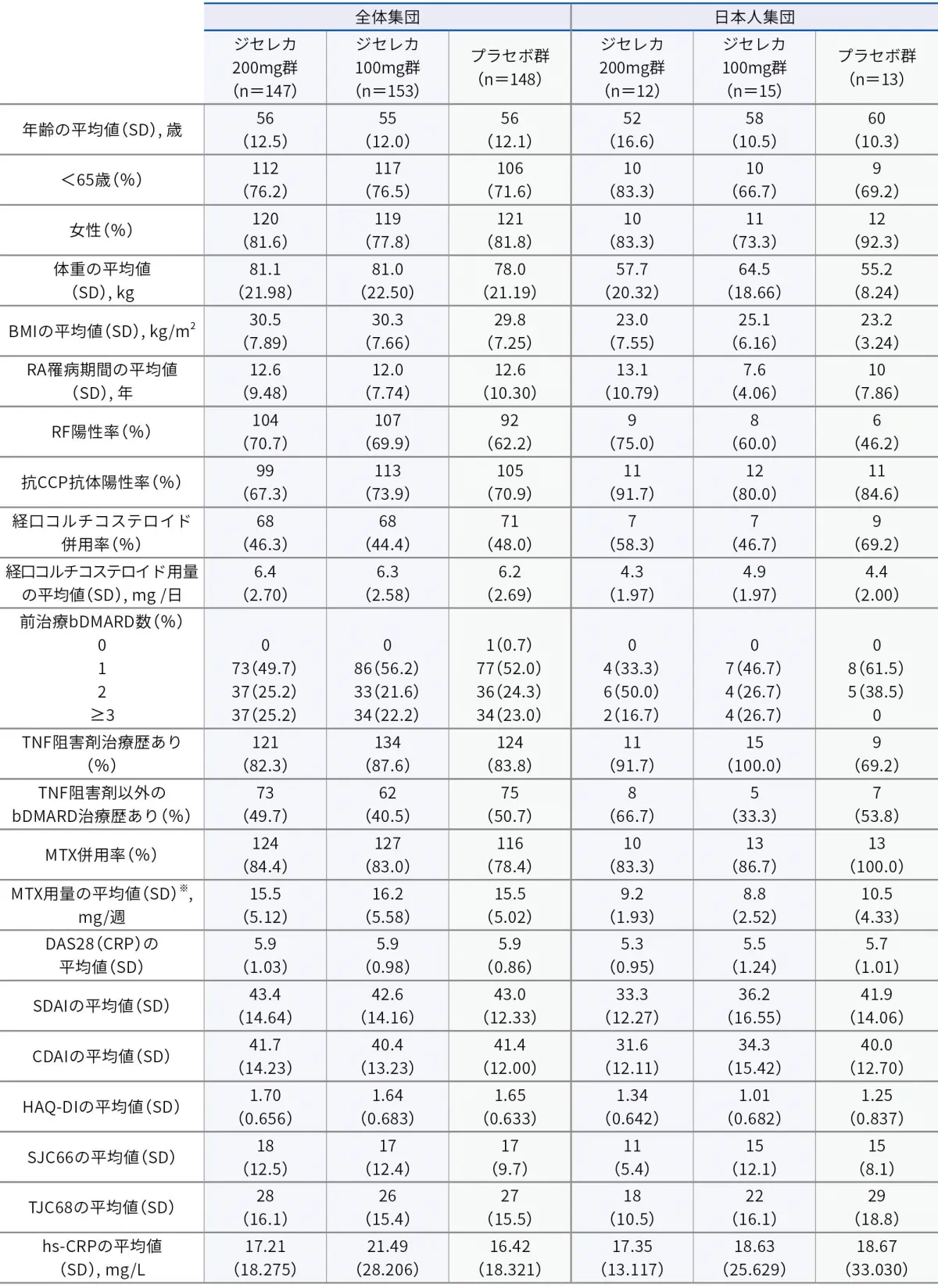
■ 患者背景(安全性解析対象集団:全体集団448例、日本人集団40例)
※メトトレキサートの国内で承認された関節リウマチに対する用法及び用量
通常、1週間単位の投与量をメトトレキサートとして6mgとし、1週間単位の投与量を1回又は2~3回に分割して経口投与する。分割して投与する場合、初日から2日目にかけて12時間間隔で投与する。1回又は2回分割投与の場合は残りの6日間、3回分割投与の場合は残りの5日間は休薬する。これを1週間ごとに繰り返す。なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減するが、1週間単位の投与量として16mgを超えないようにする。
投与12週時のACR20改善率(主要評価項目〔検証的評価項目〕)及びACR20/50/70改善率の推移(副次評価項目)
投与12週時及び投与24週時の低疾患活動性の各指標の達成率(副次評価項目、追加された評価項目)
投与12週時及び投与24週時の臨床的寛解の各指標の達成率(副次評価項目、追加された評価項目)
HAQ-DIスコアのベースラインからの変化量(副次評価項目)
bDMARDによる前治療の薬剤数別のジセレカの有効性(サブグループ解析)





