試験概要
一部承認外の成績が含まれますが、承認時評価資料のためご紹介します。
国際共同第Ⅲ相長期投与試験(FINCH4試験)1)
- 社内資料:FINCH 4[GS-US-417-0304]〔承認時評価資料〕
利益相反:本研究はGilead Sciences Inc.の支援を受けた。
利益相反:本研究はGilead Sciences Inc.の支援を受けた。
- 目的
- 中等度から重度の活動性RA患者を対象に、ジセレカ長期投与の安全性と有効性を検討する。
- 対象
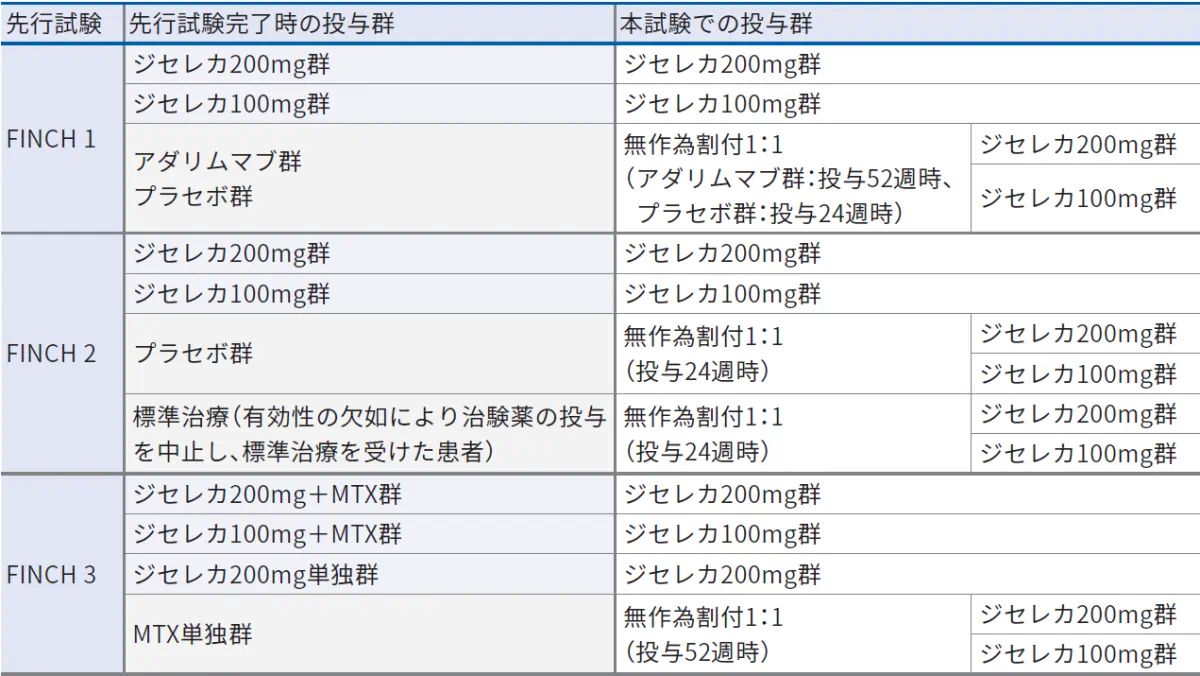
- ジセレカの国際共同第Ⅲ相臨床試験(FINCH 1試験、FINCH 2試験及びFINCH 3試験)のうち1つを完了した患者1,230例(うち日本人72例)。(中間解析(安全性解析対象集団))
- 試験デザイン
- 多施設共同、二重盲検、長期継続投与試験。
- 方法
- 対象をジセレカ200mg群又は100mg群のいずれかに割り付け、最長6年間又はジセレカの市販が開始されるまでのいずれか早い時点まで、1日1回経口投与した(進行中)。
なお、先行試験において投与されていたcsDMARDは継続し、治験責任医師又は臨床医が管理するものとした。
- 有効性評価項目
- 中間解析では有効性の評価は実施しなかった。
- 安全性評価項目
-
- 有害事象
- 特に注⽬すべき有害事象として、本剤の薬理作⽤を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を⾏った。:主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、⽇和⾒感染、B型⼜はC型肝炎ウイルス感染、深部静脈⾎栓症及び肺塞栓症、悪性腫瘍(⾮黒⾊腫⽪膚癌を除く)、⾮黒⾊腫⽪膚癌、消化管穿孔
- 解析計画
-
- 中間解析(データカットオフ日:2018年10月8日)までに得られた安全性の結果を評価した。
安全性の解析は安全性解析対象集団で実施した。 - 日本人集団における安全性について全体集団と同様にサブグループ解析を実施した。
- 中間解析(データカットオフ日:2018年10月8日)までに得られた安全性の結果を評価した。
効能又は効果(抜粋)
〇既存治療で効果不十分な関節リウマチ(関節の構造的損傷の防止を含む)
<関節リウマチ>
5. 効能又は効果に関連する注意(抜粋)
5.1 過去の治療において、メトトレキサートをはじめとする少なくとも1剤の抗リウマチ薬等による適切な治療を行っても、疾患に起因する明らかな症状が残る場合に投与すること。