安全性
安全性
■ RA患者を対象とした長期投与試験における有害事象の概要(安全性解析対象集団)
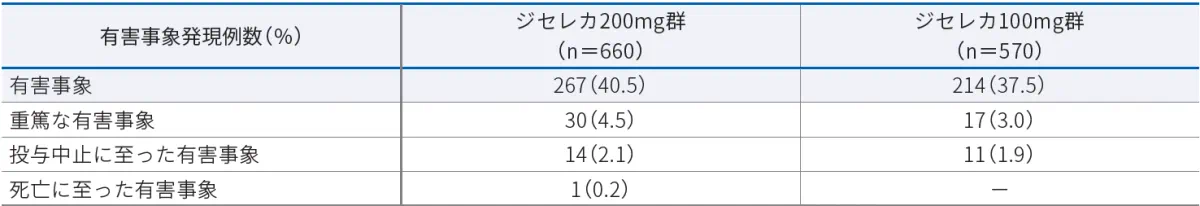
有害事象
本試験において、有害事象はジセレカ200mg群で40.5%(267/660例)、ジセレカ100mg群で37.5%(214/570例)に認められました。主な有害事象(2%以上)は以下のとおりでした。
- ジセレカ200mg群:尿路感染23例(3.5%)、上咽頭炎20例(3.0%)、上気道感染16例(2.4%)、悪心15例(2.3%)、関節痛13例(2.0%)
- ジセレカ100mg群:RA 21例(3.7%)、上咽頭炎14例(2.5%)、高血圧12例(2.1%)
重篤な有害事象
本試験において、重篤な有害事象はジセレカ200mg群で4.5%(30/660例)、ジセレカ100mg群で3.0%(17/570例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:30例(心房細動3例、急性腎障害、急性呼吸不全、細菌性関節炎各2例、呼吸困難、肺炎、蜂巣炎、肺塞栓症、急性心筋梗塞、アルコール乱用、貧血、ブルセラ症、心臓アブレーション、チクングニヤウイルス感染、急性胆管炎、急性胆嚢炎、冠動脈疾患、深部静脈血栓症、医療機器のゆるみ、脳症、エプスタイン・バーウイルス血症、転倒、坐骨骨折、胃穿孔、びらん性胃炎、性器出血、肝炎、帯状疱疹、ヒトのエールリッヒア症、関節損傷、限局性感染、腰髄神経根障害、肺腺癌、筋痙縮、非小細胞肺癌、変形性関節症、卵巣癌第3期、肺炎球菌性肺炎、肺臓炎、肺高血圧症、腎盂腎炎、右室機能不全、敗血症、胸椎骨折、血小板減少症、表在性血栓性静脈炎各1例)
- ジセレカ100mg群:17例(呼吸困難、肺炎、気管支炎各2例、蜂巣炎、肺塞栓症、自然流産、虫垂炎、喘息、脱水、喀血、肝毒性、高カルシウム血症、高血圧、白血球増加症、結核性髄膜炎、精神状態変化、腎結石症、好中球減少症、非心臓性胸痛、骨髄炎、部分発作、原発性アミロイドーシス、前立腺癌、肺結核、RA、T細胞性リンパ腫、尿路性敗血症各1例)
投与中止に至った有害事象
本試験において、投与中止に至った有害事象はジセレカ200mg群で2.1%(14/660例)、ジセレカ100mg群で1.9%(11/570例)に認められました。投与中止に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:14例(急性腎障害、ALT増加、細菌性関節炎、AST増加各2例、肺塞栓症、急性心筋梗塞、急性呼吸不全、貧血、心房細動、菌血症、ブルセラ症、チクングニヤウイルス感染、深部静脈血栓症、脳症、エプスタイン・バーウイルス血症、γ-グルタミルトランスフェラーゼ増加、胃穿孔、B型肝炎DNA測定陽性、ヒトのエールリッヒア症、高血圧、非小細胞肺癌、肺炎、肺炎球菌性肺炎、皮膚潰瘍、血小板減少症、表在性血栓性静脈炎、尿路感染各1例)
- ジセレカ100mg群:11例(RA 2例、肺塞栓症、血管浮腫、潜伏結核、白血球減少症、精神的機能障害、結核菌群検査陽性、好中球減少症、骨髄炎、原発性アミロイドーシス、T細胞性リンパ腫、結核各1例)
死亡に至った有害事象
本試験において認められた死亡に至った有害事象は以下のとおりでした。
- ジセレカ200mg群:1例(肺腺癌)
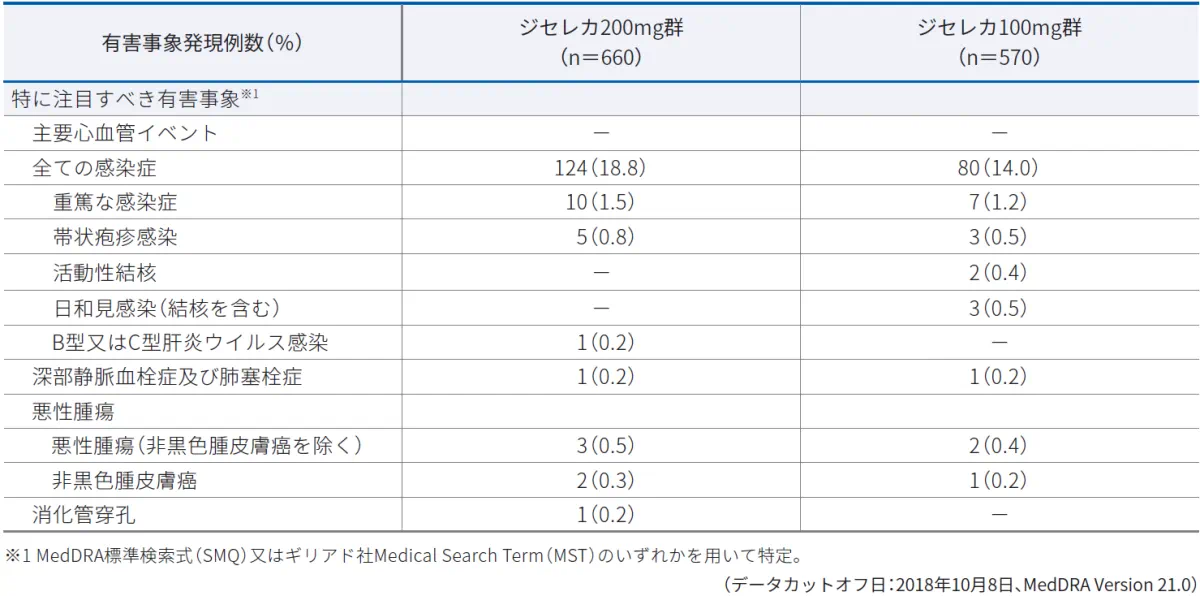
特に注目すべき有害事象※1
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
■特に注目すべき有害事象
日本人集団における安全性(サブグループ解析)
■RA患者を対象とした長期投与試験における有害事象の概要(日本人の安全性解析対象集団)

本試験の日本人集団において、有害事象はジセレカ200mg群で42.1%(16/38例)、ジセレカ100mg群で50.0%(17/34例)に認められました。主な有害事象(全体集団のいずれかの群で2%以上)は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎4例(10.5%)、RA 2例(5.3%)、悪心1例(2.6%)
- ジセレカ100mg群:上咽頭炎5例(14.7%)、RA 1例(2.9%)、悪心1例(2.9%)、高血圧1例(2.9%)
重篤な有害事象はジセレカ100mg群で2.9%(1/34例)で自然流産が認められました。
特に注目すべき有害事象※2
本試験において、特に注目すべき有害事象として、本剤の薬理作用を踏まえ、投与に関連する可能性のある次の有害事象を事前に規定し重点的に検討を行いました。
主要心血管イベント、全ての感染症、重篤な感染症、帯状疱疹感染、活動性結核、日和見感染、B型又はC型肝炎ウイルス感染、深部静脈血栓症及び肺塞栓症、悪性腫瘍(非黒色腫皮膚癌を除く)、非黒色腫皮膚癌、消化管穿孔
本試験の日本人集団において、特に注目すべき有害事象※2は、以下のとおりでした。
- ジセレカ200mg群:全ての感染症7例(18.4%)
- ジセレカ100mg群:全ての感染症6例(17.6%)
※2 MedDRA標準検索式(SMQ)又はギリアド社Medical Search Term(MST)のいずれかを用いて特定。





