DI情報
| 電子添文 |
|---|
|
2026.01 お知らせ_202601 |
| 製剤写真 |
|---|
|
製剤写真はこちらからも
ご覧いただけます。 |
| くすりのしおり |
|---|
| 市販直後調査(EPPV) |
|---|
| 最終報告書(2022/3/28~2022/9/27) |
| 特定使用成績調査(全例調査) |
|---|
| 中間報告 ジセレカ錠 適正使用情報 |
1.警告 2.禁忌 4.効能又は効果 5.効能又は効果に関する注意 6.用法及び用量 7.用法及び用量に関する注意
8.重要な基本的注意 9.特定の背景を有する患者に関する注意
その他の情報は電子添文をご確認ください
1.警告
1.警告(抜粋)
<効能共通>
1.1 本剤投与により、結核、肺炎、敗血症、ウイルス感染等による重篤な感染症の新たな発現もしくは悪化等が報告されており、本剤との関連性は明らかではないが、悪性腫瘍の発現も報告されている。本剤が疾病を完治させる薬剤でないことも含め、これらの情報を患者に十分説明し、患者が理解したことを確認した上で、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
また、本剤投与により重篤な副作用が発現し、致死的な経過をたどった症例が報告されているので、緊急時の対応が十分可能な医療施設及び医師が使用すること。また、本剤投与後に有害事象が発現した場合には、主治医に連絡するよう患者に注意を与えること。[1.2.1、1.2.2、2.2、2.3、8.1、8.2、8.7 、9.1.1-9.1.3 、11.1.1 、15.1.1 、15.1.2 、15.1.4-15.1.6 参照]
1. 2 感染症
1.2.1 重篤な感染症
肺炎、敗血症、日和見感染症等の致命的な感染症が報告されているため、十分な観察を行うなど感染症の発現に注意すること。[1.1、2.2、8.1、9.1.1、9.1.3、11.1.1、15.1.1、15.1.5 参照]
1. 2. 2 結核
肺外結核(結核性髄膜炎)を含む結核が報告されている。結核の既感染者では症状の顕在化及び悪化のおそれがあるため、本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロンγ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。結核の既往歴を有する患者及び結核の感染が疑われる患者には、結核等の感染症について診療経験を有する医師と連携の下、原則として本剤投与前に適切な抗結核薬を投与すること。ツベルクリン反応検査等の検査が陰性の患者において、投与後活動性結核が認められた例も報告されている。[1.1、2.3、8.2、9.1.2、11.1.1 参照]
<潰瘍性大腸炎>
1.4 本剤の治療を行う前に、少なくとも1剤の既存治療薬(ステロイド、免疫抑制剤等)の使用を十分勘案すること。また、本剤
についての十分な知識と潰瘍性大腸炎治療の経験をもつ医師が使用すること。
2.禁忌
2.禁忌(次の患者には投与しないこと)
2. 1 本剤の成分に対し過敏症の既往歴のある患者
2. 2 重篤な感染症(敗血症等)の患者[症状が悪化するおそれがある。][ 1.1 、1.2.1 、8.1 、9.1.1 、9.1.3 、11.1.1、15.1.1、15.1.5 参照]
2. 3 活動性結核の患者[症状が悪化するおそれがある。][1.1、1.2.2、8.2、9.1.2、11.1.1 参照]
2. 4 末期腎不全患者[7.1、9.2.1、16.6.1 参照]
2. 5 重度の肝機能障害を有する患者[9.3.1、11.1.4、16.6.2参照]
2. 6 好中球数が1000/mm3未満の患者[8.6、9.1.9、11.1.3 参照]
2. 7 リンパ球数が500/mm3未満の患者[8.6、9.1.10、11.1.3参照]
2. 8 ヘモグロビン値が8g/dL未満の患者[8.6、9.1.11、11.1.3参照]
2. 9 妊婦又は妊娠している可能性のある女性[9.5 参照]
4.効能又は効果(抜粋)
〇中等症から重症の潰瘍性大腸炎の治療及び維持療法(既存治療で効果不十分な場合に限る)
5.効能又は効果に関する注意(抜粋)
<潰瘍性大腸炎>
5.2 過去の治療において、少なくとも1剤の既存治療薬(ステロイド、免疫抑制剤等)による適切な治療を行っても、疾患に起因する明らかな臨床症状が残る場合に投与すること。
5.3 本剤は生物製剤で効果不十分又は不耐容な潰瘍性大腸炎患者を対象とした寛解導入試験において、主要評価項目である投与10週時に寛解を達成した被験者の割合で、プラセボ群との有意差が認められていないことから、「17.臨床成績」の項の内容を十分理解した上で、適応患者を選択すること。[17.1.4 参照]
6.用法及び用量(抜粋)
<潰瘍性大腸炎>
通常、成人にはフィルゴチニブとして200mgを1日1回経口投与する。なお、維持療法では、患者の状態に応じて100mgを1日1回投与できる。
7.用法及び用量に関する注意(抜粋)
<効能共通>
7.1 中等度又は重度の腎機能障害のある患者には、100mgを1日1回経口投与する。[2.4、9.2.1-9.2.3、16.6.1 参照]

<潰瘍性大腸炎>
7.3 本剤の投与開始後10週を目安として効果の有無を判断し、臨床症状や内視鏡所見等による治療反応が得られない場合は、他の治療法への切り替えを考慮すること。
7.4 免疫抑制作用が増強されると感染症のリスクが増加することが予想されるので、本剤とTNFα阻害剤、インテグリン阻害剤、インターロイキン阻害剤等の生物製剤や他のJAK阻害剤、タクロリムス、シクロスポリン等の免疫抑制剤(局所製剤以外)との併用はしないこと。本剤とこれらの薬剤との併用経験はない。[8.1 参照]
8.重要な基本的注意
8.1 本剤は、免疫反応に関与するJAKファミリーを阻害するので、感染症に対する宿主免疫能に影響を及ぼす可能性がある。本剤の投与に際しては十分な観察を行い、感染症の発現や増悪に注意すること。また、患者に対し、発熱、倦怠感等があらわれた場合には、速やかに主治医に相談するよう指導すること。[1.1、1.2.1、2.2、7.2、7.4、9.1.1、9.1.3、11.1.1 参照]
8.2 本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロンγ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。本剤投与中は胸部X線検査等の適切な検査を定期的に行うなど結核の発現には十分に注意すること。患者に対し、結核を疑う症状が発現した場合(持続する咳、発熱等)には速やかに主治医に連絡するよう説明すること。[1.1、1.2.2、2.3、9.1.2、11.1.1 参照]
8.3 本剤によるB型肝炎ウイルスの再活性化が報告されているので、投与に先立って、B型肝炎ウイルス感染の有無を確認すること。[9.1.4 参照]
8.4 播種性を含む帯状疱疹が報告されている。ヘルペスウイルス等の再活性化の徴候や症状の発現に注意すること。徴候や症状の発現が認められた場合には、患者に受診するよう説明し、本剤の投与を中断し、速やかに適切な処置を行うこと。また、ヘルペスウイルス以外のウイルスの再活性化にも注意すること。[11.1.1 参照]
8.5 感染症発現のリスクを否定できないので、本剤開始直前及び投与中の生ワクチン接種は行わないこと。
8.6 好中球減少、リンパ球減少及びヘモグロビン減少があらわれることがあるので、投与前の検査値を測定するとともに本剤投与開始後は定期的に好中球数、リンパ球数及びヘモグロビン値を確認すること。[2.6-2.8、9.1.9-9.1.11、11.1.3 参照]
8.7 本剤との因果関係は確認されていないが、悪性腫瘍の発現には注意すること。悪性リンパ腫、固形癌等の悪性腫瘍の発現が報告されている。[1.1、15.1.2、15.1.4、15.1.6 参照]
8.8 総コレステロール、LDLコレステロール、HDLコレステロール及びトリグリセリドの上昇等の脂質検査値異常があらわれることがある。本剤投与開始後は定期的に脂質検査値を確認すること。臨床上必要と認められた場合には、脂質異常症治療薬の投与等の適切な処置を考慮すること。
8.9 トランスアミナーゼ値の上昇があらわれることがあるので、ベースラインを測定するとともに、本剤投与中は観察を十分に行うこと。[11.1.4 参照]
9.特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 感染症(重篤な感染症を除く)の患者又は感染症が疑われる患者[1.1、1.2.1、2.2、8.1、11.1.1 参照]
9.1.2 結核の既感染者(特に結核の既往歴のある患者及び胸部レントゲン上結核治癒所見のある患者)又は結核感染が疑われる患者
(1) 結核の既感染者では、結核を活動化させるおそれがある。[1.1、1.2.2、2.3、8.2、11.1.1 参照]
(2) 結核の既往歴を有する場合及び結核感染が疑われる場合には、結核の診療経験がある医師に相談すること。以下のいずれかの患者には、原則として本剤投与前に適切な抗結核薬を投与すること。[1.1、1.2.2、2.3、8.2、11.1.1 参照]
・ 胸部画像検査で陳旧性結核に合致するか推定される陰影を有する患者
・ 結核の治療歴(肺外結核を含む)を有する患者
・ インターフェロン-γ遊離試験やツベルクリン反応検査等の検査により、既感染が強く疑われる患者
・ 結核患者との濃厚接触歴を有する患者
9.1.3 易感染性の状態にある患者
感染症を発現するリスクが増加する。[1.1、1.2.1、2.2、8.1、11.1.1 参照]
9.1.4 B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
肝機能検査値やHBV DNAモニタリングを行うなど、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意すること。本剤によるB型肝炎ウイルスの再活性化が報告されている。なお、活動性B型肝炎の患者は臨床試験では除外されている。[8.3 参照]
9.1.5 C型肝炎患者
活動性C型肝炎の患者は臨床試験では除外されている。
9.1.6 腸管憩室のある患者
消化管穿孔があらわれるおそれがある。[11.1.2 参照]
9.1.7 静脈血栓塞栓症のリスクを有する患者[11.1.6 参照]
9.1.8 間質性肺炎の既往歴のある患者
定期的に問診を行うなど、注意すること。間質性肺炎があらわれるおそれがある。[11.1.5 参照]
9.1.9 好中球減少(好中球数1000/mm3未満を除く)のある患者
好中球減少が更に悪化するおそれがある。[2.6、8.6、11.1.3参照]
9.1.10 リンパ球減少(リンパ球数500/ mm3未満を除く)のある患者
リンパ球減少が更に悪化するおそれがある。[2.7、8.6、11.1.3 参照]
9.1.11 ヘモグロビン値減少(ヘモグロビン値8g/dL未満を除く)のある患者
ヘモグロビン減少が更に悪化するおそれがある。[2.8、8.6、11.1.3 参照]
9.2 腎機能障害患者
9.2.1 末期腎不全患者(eGFR<15mL/min/1.73m2)
投与しないこと。末期腎不全患者は臨床試験で除外されている。腎機能が正常な患者に比べ、フィルゴチニブの主要代謝物であるGS-829845の曝露量が増加するため、副作用が強くあらわれるおそれがある。[2.4、7.1、16.6.1 参照]
9.2.2 重度の腎機能障害患者(15≦eGFR<30mL/min/1.73m2)
本剤投与の適否を慎重に検討した上で、100mgを1日1回投与すること。また、本剤投与中は患者の状態を十分観察し、副作用の発現に注意すること。腎機能が正常な患者に比べ、フィルゴチニブの主要代謝物であるGS-829845の曝露量が有意に増加するため、副作用が強くあらわれるおそれがある。[7.1、16.6.1参照]
9.2.3 中等度の腎機能障害患者( 3 0 ≦ e G F R < 6 0 m L /min/1.73m2)
100mgを1日1回投与すること。腎機能が正常な患者に比べ、フィルゴチニブの主要代謝物であるGS-829845の曝露量が有意に増加する。[7.1、16.6.1 参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
投与しないこと。重度の肝機能障害(Child-Pugh分類C)のある患者は臨床試験で除外されている。肝機能が正常な患者に比べ、本剤の曝露量が増加し、副作用が強くあらわれるおそれがある。[2.5、11.1.4、16.6.2 参照]
9.4 生殖能を有する者
9.4.1 妊娠可能な女性には、本剤投与中及び本剤投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5 参照]
9.4.2 生殖可能な男性には、本剤投与による精子形成障害に伴う妊孕性低下の可能性について説明した上で、投与を開始すること。動物試験において、ラットではヒトにフィルゴチニブ200mgを1日1回投与したときの約7.3倍の曝露量(AUC)で精子形成障害及び受胎能の低下が認められ、イヌではヒトにフィルゴチニブ200mgを1日1回投与したときの約5.1倍の曝露量(AUC)で精子形成障害が認められている1)。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。
ラット及びウサギにおいて、ヒトにフィルゴチニブ200mgを1日1回投与したときと同程度の曝露量で胚致死作用及び催奇形性(内臓及び骨格奇形)が認められている2),3)。[2.9、9.4.1 参照]
9.6 授乳婦
本剤投与中は授乳しないことが望ましい。動物実験では授乳中の仔ラットの血漿中に、乳汁由来と考えられるフィルゴチニブが検出された。ヒト母乳中への移行は不明である4)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら、用量に留意して慎重に投与すること。一般に生理機能が低下している。
1)社内資料:雄生殖毒性
2)社内資料:胚・胎児発生に関する試験(ラット)[GLPG0634-TX-016]
3)社内資料:胚・胎児発生に関する試験(ウサギ)[GLPG0634-TX-019]
4)社内資料:出生前及び出生後の発生並びに母体の機能に関する試験(ラット)[TX-417-2001]
製剤・包装写真
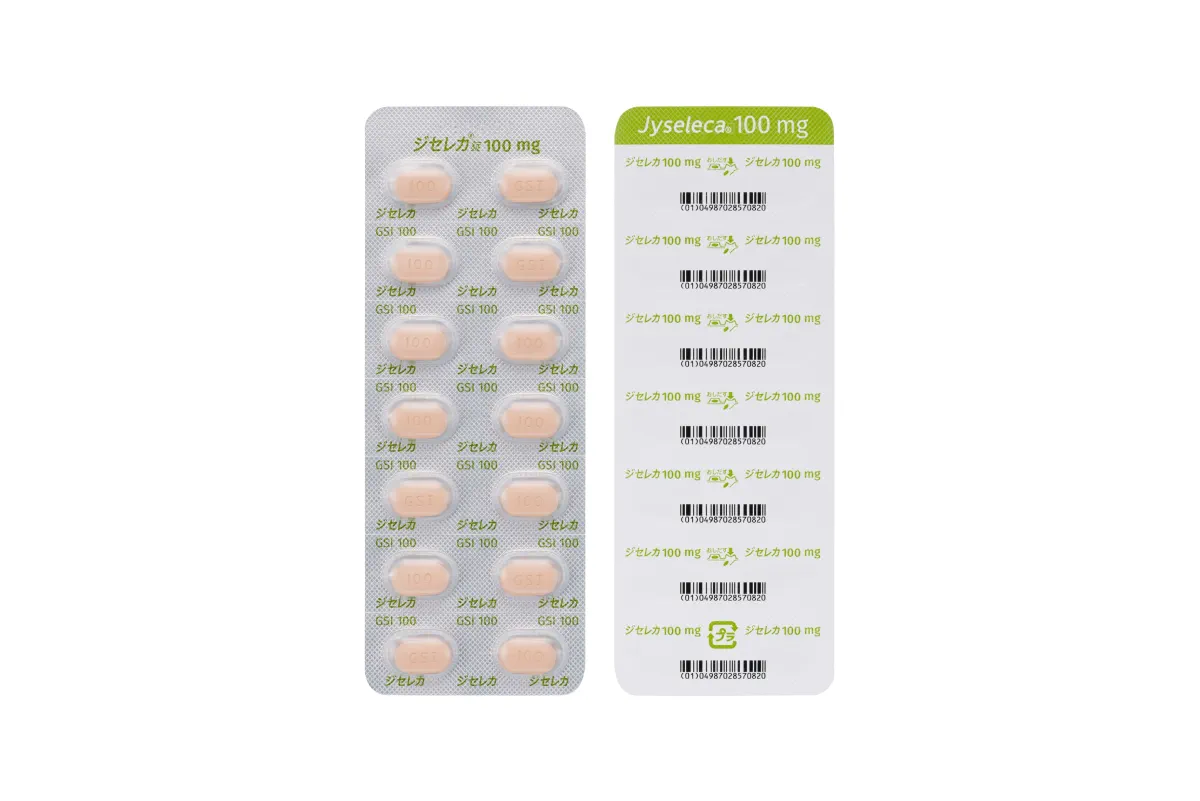
ジセレカ®錠 100 mg
製剤写真
表

裏

横

包装写真 14錠(14錠×1)PTP


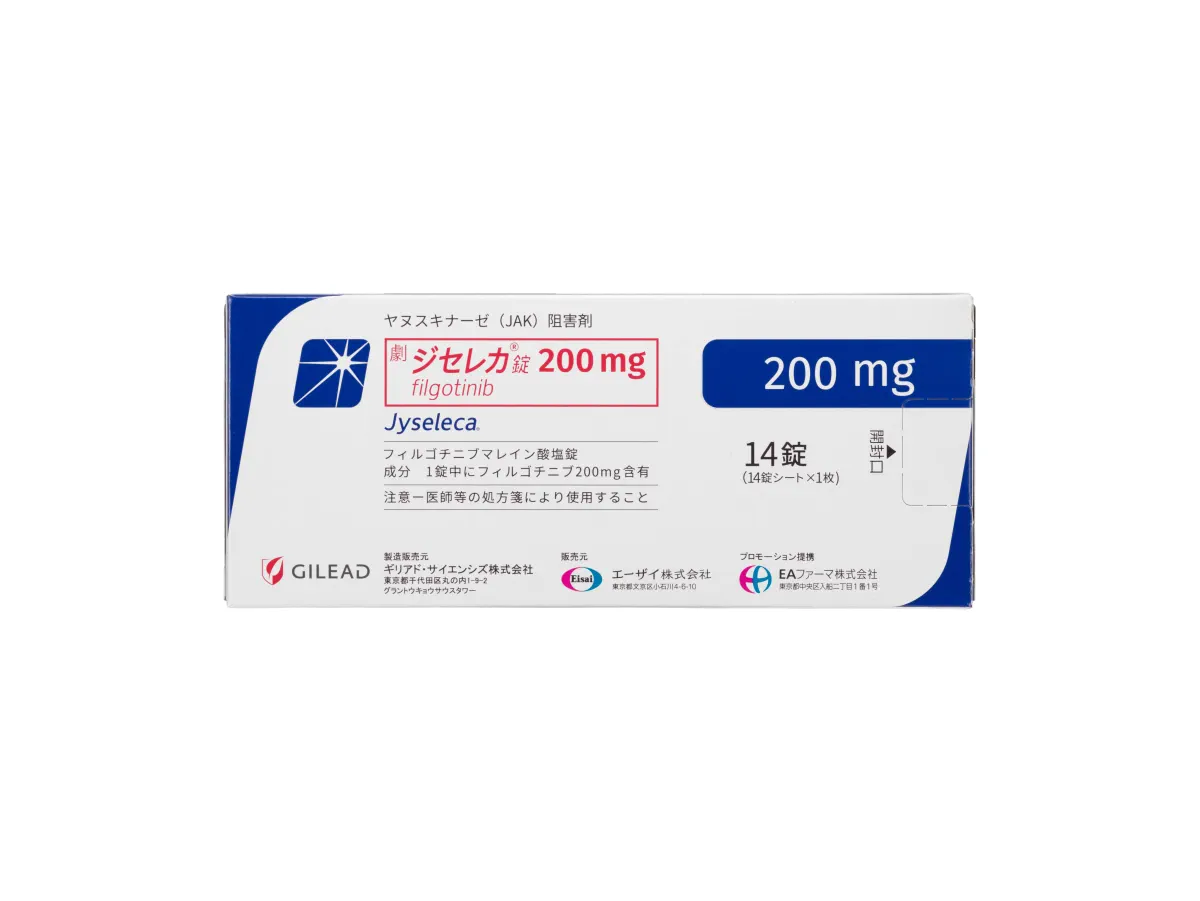
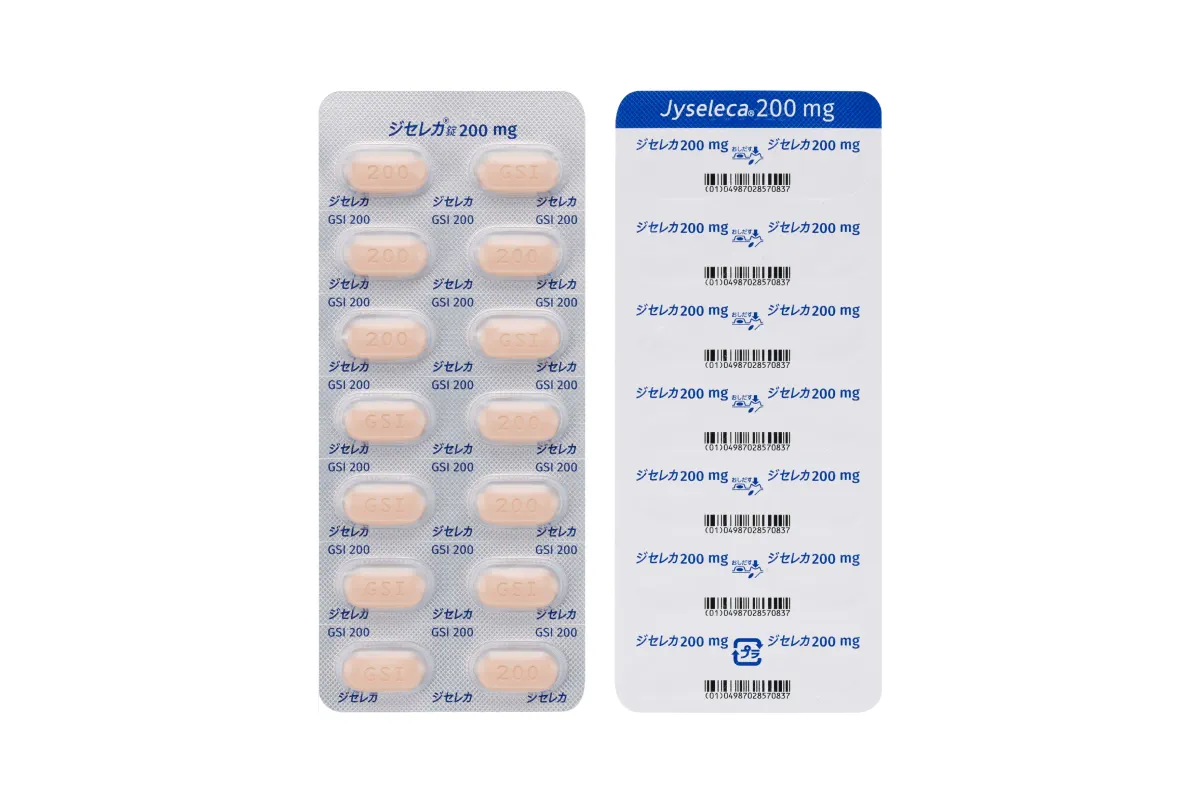
ジセレカ ®錠 200 mg
製剤写真
表

裏

横

包装写真 14錠(14錠×1)PTP

ダウンロードする場合は、画像の上で右クリックし、「名前を付けて画像を保存」を選択しファイルを保存してください。






