試験概要:中等症から重症の活動性潰瘍性大腸炎患者における国際共同第Ⅱb/Ⅲ相試験(SELECTION試験)寛解導入期
社内資料:SELECTION(2022年3月承認)〔承認時評価資料〕
Feagan BG, et al. Lancet. 397(10292):2372 - 2384, 2021
利益相反:本研究はGilead Sciences Inc. の資金提供により行われた。
一部承認外の成績が含まれるデータですが、承認時評価資料のためご紹介します。
目的
中等症から重症の活動性潰瘍性大腸炎患者に対する寛解導入療法及び維持療法におけるジセレカの有効性及び安全性を評価する。
対象
中等症から重症の活動性潰瘍性大腸炎患者
- 寛解導入試験:Biologic-Naïve 659例(うち日本人37例)、Biologic-Experienced 689例(うち日本人72例)
主な選択基準
<寛解導入試験(Biologic-Naïve及びBiologic-Experienced)の主な適格性基準>
- 18歳以上75歳以下の男性又は女性(妊娠中及び授乳中を除く)
- UCと診断され、罹患から少なくとも6ヵ月間経過
- 肛門縁から少なくとも15cmに及ぶ病変が確認されている
- スクリーニング時の内視鏡検査でMayoスコアリングシステムに基づく内視鏡スコア(中央判定)2以上、直腸出血スコア1以上、排便回数スコア1以上及び医師による全般評価(PGA)スコア2以上(合計スコアが6以上12以下)の中等症から重症の活動性UCを有する患者
- 寛解導入試験の被験者は、一定用量の経口5-ASA製剤、免疫調節剤(アザチオプリン、6-MP※1、MTX※1)及び経口ステロイド剤(プレドニゾン※2は30mg/日以下、ブデソニドは9mg/日以下の一定用量であること)を併用可
- クローン病、鑑別困難な(indeterminate)大腸炎、虚血性大腸炎、劇症型大腸炎、孤発性の潰瘍性直腸炎又は中毒性巨大結腸症を有していない患者
- 活動性結核又は未治療の潜在性結核を有していない患者
- Biologic-Naïve寛解導入試験に特有の適格性基準:過去にステロイド剤又は免疫調節剤で効果不十分若しくは無効又は不耐容であり、TNFα阻害剤又はベドリズマブによる前治療歴がなく現在も使用していない
- Biologic-Experienced寛解導入試験に特有の適格性基準:過去にTNFα阻害剤又はベドリズマブで効果不十分若しくは無効又は不耐容
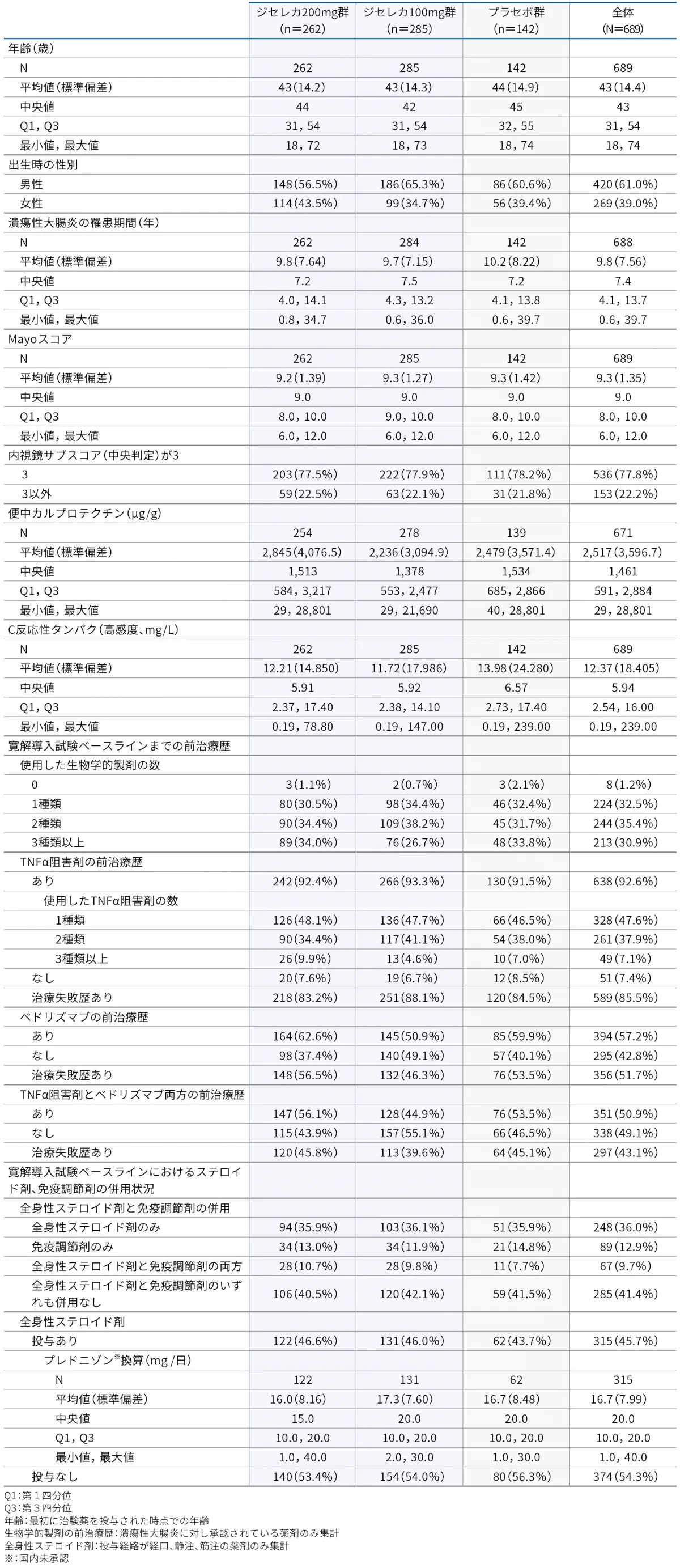
試験デザイン
ランダム化、二重盲検、プラセボ対照、統合第Ⅱb/Ⅲ相試験
方法
<寛解導入試験(Day 1~Week 11)>
被験者をBiologic-Naïve寛解導入試験又はBiologic-Experienced寛解導入試験に組み入れた後、盲検下でジセレカ200mg群、ジセレカ100mg群又はプラセボ群のいずれかに2:2:1の比率でランダム割り付けした。米国及び韓国の男性被験者で、dual refractory※3と判断されなかった被験者については、ジセレカ100mg群又はプラセボ群のいずれかに2:1の比率でランダム割り付けした。治験薬は、1日1回経口投与した。
Biologic-Naïve寛解導入試験において、生物学的製剤に未治療の被験者を以下の因子により層別化した。
- Day 1時点での全身性経口ステロイド剤(プレドニゾン※2など)の併用の有無
- Day 1時点での免疫調節剤(6-MP※1、アザチオプリン、MTX※1など)の併用の有無
Biologic-Experienced寛解導入試験において、生物学的製剤に既治療の被験者を以下の因子により層別化した。
- 生物学的製剤による前治療歴(1種類又は2種類以上)
- Day 1時点での全身性経口ステロイド剤(プレドニゾン※2など)の併用の有無
- Day 1時点での免疫調節剤(6-MP※1、アザチオプリン、MTX※1など)の併用の有無
Week 10時点で、臨床的寛解(EBS寛解)及び臨床的改善(MCS改善)に基づいて有効性を評価した。被験者は、Week 10の終了時からWeek 11の再ランダム化までの間、割り付けられた治療を盲検下で継続した。
<有効性評価項目>
主要評価項目(検証的評価項目)
- Week 10時点での臨床的寛解率(EBS寛解率)
副次評価項目
- Week 10時点でのMCS寛解率
- Week 10時点での内視鏡的寛解率(内視鏡サブスコア0達成率)
- Week 10時点でのGeboes組織学的寛解率
- Week 10時点でのMCS寛解(別の定義)率
探索的評価項目
- Week 10時点での内視鏡的改善率(内視鏡サブスコア0又は1達成率)
- Week 10時点での臨床的改善率(MCS改善率)
- Week 10時点での臨床的寛解(EBS寛解)(別の定義)率
- 各来院時での部分MCSのベースラインからの変化量
- Week 10時点での健康関連QOLスコアのベースラインからの変化量
- 各来院時でのバイオマーカーのベースラインからの変化量
<安全性評価項目>
有害事象(寛解導入試験、寛解維持試験)
注目すべき有害事象として、既承認のJAK阻害剤との関連性が示唆されている次の有害事象を事前に規定し、安全性事象の発現状況を検討するため、包括的解析を実施した。:感染症(全ての感染症、重篤な感染症、帯状疱疹及び日和見感染)、消化管穿孔、NMSCを除く悪性腫瘍、NMSC及び血栓塞栓症イベント(静脈血栓症、肺塞栓症、動脈血栓症及び脳血管イベント)
解析計画
<解析対象集団>
有効性の主要解析は最大の解析対象集団(FAS)を対象として実施した。
なお、Biologic-Experienced寛解導入試験の日本国内での申請を目的とした主たる解析(Japan specific analysis)は、医薬品医療機器総合機構(PMDA)からの助言に従って実施した。すなわち、ジセレカ200mg群の有効性をプラセボ群と比較する主要解析は、プラセボ群に含まれる米国/韓国のdualrefractory(TNFα阻害剤及びベドリズマブの両剤で治療不成功)ではない男性被験者を除外したFASを対象として行った。
ジセレカ200mg群の有効性に関する副次解析及びジセレカ100mg群の有効性に関する主要/副次解析は、全てのFASを対象として行った(Global analysis)。
<寛解導入試験>
寛解導入試験のFASは、ランダム割り付けされ、治験薬を少なくとも1回投与された全ての被験者とした。寛解導入試験での有効性の主要解析では、主要評価項目に関するジセレカ200mg及び100mgのプラセボに対する優越性の検定を行った。各寛解導入試験では、層別Cochran-Mantel-Haenszel (CMH)検定※5により、ジセレカ200mg群とプラセボ群及びジセレカ100mg群とプラセボ群での治療効果を比較した。
Bonferroni法を用いて、ジセレカ各群とプラセボ群の比較検定に有意水準(両側)0.025を等しく配分し、各試験内で全体での第一種の過誤確率を0.05に制御した。
各寛解導入試験において無益性判定のための盲検解除を伴う中間解析を実施したことから、寛解導入試験の完全性を維持するため、ジセレカ各群とプラセボ群との比較で0.00001のαを消費した。その結果、寛解導入試験の最終的な主要解析で、ジセレカ各群が統計学的に有意であることを示すためには、p値(両側)が0.02499未満である必要があった。
主要解析で、ジセレカ200mg又は100mgのプラセボに対する優越性が検証された場合には、引き続きジセレカの同用量群について、以下の順序により主な副次仮説(ジセレカ群とプラセボ群で同等である)に関する検定を同じ有意水準で実施した。

EBS:endoscopy/bleeding/stool frequency、内視鏡所見/直腸出血/排便回数
MCS:Mayo Clinic Score、Mayoスコア
※1:潰瘍性大腸炎に対しては国内未承認
※2:国内未承認
※3:TNFα阻害剤及びベドリズマブの両剤で治療不成功
※4:ステロイド剤は、プレドニゾン※2換算で1週間ごとに2.5㎎~5㎎ずつ、ステロイドフリーに至るまで漸減した。ブデソニドの場合は、3週間ごとに3mg/日ずつ漸減した。
※5:層別因子は、Biologic-Naïve寛解導入試験ではDay 1時点の全身性経口ステロイド剤の併用の有無及びDay 1時点の免疫調節剤の併用の有無、Biologic-Experienced寛解導入試験ではDay 1時点の全身性経口ステロイド剤の併用の有無、Day 1時点の免疫調節剤の併用の有無及び生物学的製剤による前治療歴(1種類又は2種類以上)とした。
※6:層別因子は、寛解導入試験での参加コホート(Biologic-Naïve又はBiologic-Experienced)、寛解維持試験のベースライン時点の全身性経口ステロイド剤の併用の有無及び寛解維持試験のベースライン時点の免疫調節剤の併用の有無とした。
■中等症から重症の活動性潰瘍性大腸炎患者における国際共同第Ⅱb/Ⅲ相試験:試験デザイン
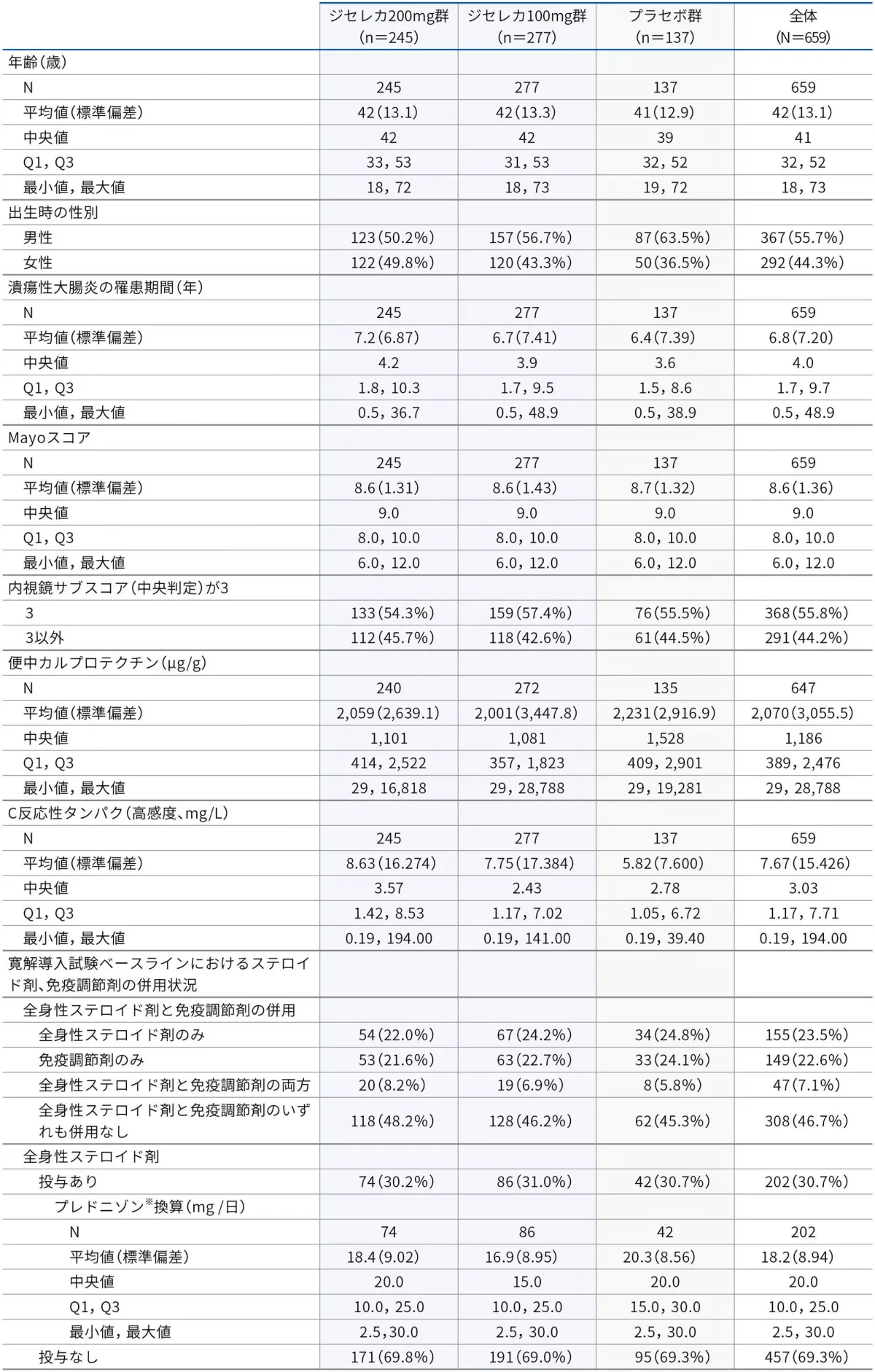
■患者背景(Biologic-Naïve、安全性解析対象集団)
Q1:第1四分位
Q3:第3四分位
年齢:最初に治験薬を投与された時点での年齢
全身性ステロイド剤:投与経路が経口、静注、筋注の薬剤のみ集計
※:国内未承認
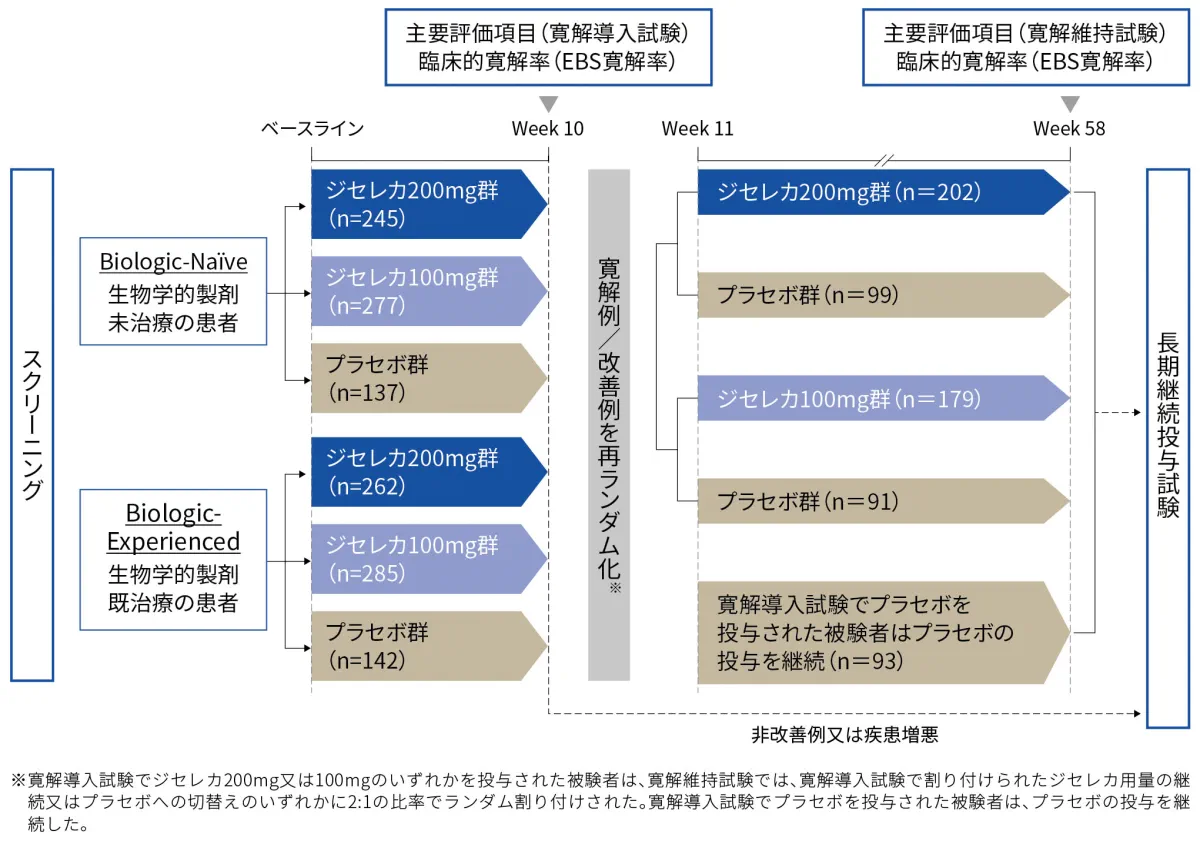
■患者背景(Biologic-Experienced、安全性解析対象集団)