安全性
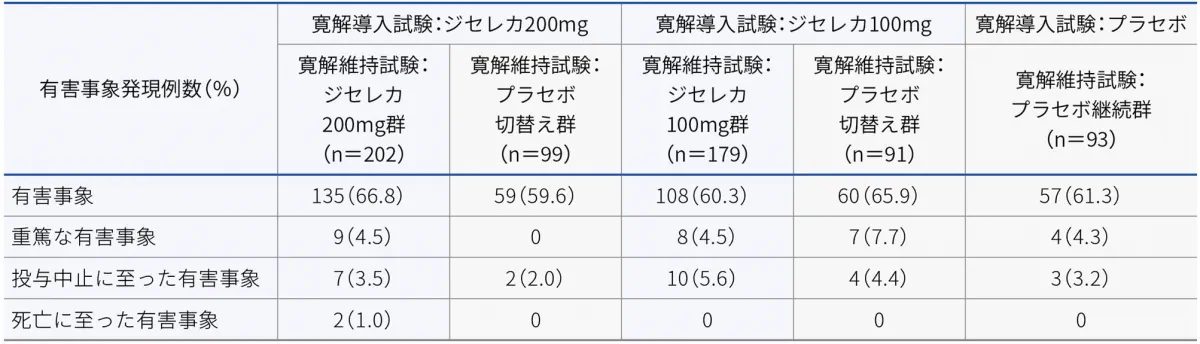
■有害事象の概要(安全性解析対象集団)
有害事象
寛解維持試験における有害事象は、ジセレカ200mg群で66.8%(135/202例)、ジセレカ200mgからのプラセボ切替え群で59.6%(59/99例)、ジセレカ100mg群で60.3%(108/179例)、ジセレカ100mgからのプラセボ切替え群で65.9%(60/91例)、プラセボ継続群で61.3%(57/93例)に認められました。主な有害事象は以下のとおりでした。
- ジセレカ200mg群:上咽頭炎22例(10.9%)、潰瘍性大腸炎21例(10.4%)及び上気道感染11例(5.4%)
- ジセレカ200mgからのプラセボ切替え群:潰瘍性大腸炎20例(20.2%)、関節痛7例(7.1%)、腹痛6例(6.1%)及び上咽頭炎6例(6.1%)
- ジセレカ100mg群:潰瘍性大腸炎19例(10.6%)、上咽頭炎12例(6.7%)及び頭痛11例(6.1%)
- ジセレカ100mgからのプラセボ切替え群:潰瘍性大腸炎16例(17.6%)、上咽頭炎6例(6.6%)及び頭痛5例(5.5%)
- プラセボ継続群:潰瘍性大腸炎11例(11.8%)、上咽頭炎5例(5.4%)及び頭痛5例(5.4%)
重篤な有害事象
寛解維持試験における重篤な有害事象は、ジセレカ200mg群で4.5%(9/202例)、ジセレカ200mgからのプラセボ切替え群で0%、ジセレカ100mg群で4.5%(8/179例)、ジセレカ100mgからのプラセボ切替え群で7.7%(7/91例)、プラセボ継続群で4.3%(4/93例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:9例(虫垂炎、発熱、喘息、尿路結石、胸痛、憩室炎、左室不全、悪性黒色腫、腱断裂各1例)
- ジセレカ200mgからのプラセボ切替え群:0例
- ジセレカ100mg群:8例(虫垂炎2例、潰瘍性大腸炎、発熱、腹痛、無気肺、蜂巣炎、胆石症、結腸癌、呼吸困難、非心臓性胸痛、急性膵炎、爪囲炎、肺腫瘤、一過性脳虚血発作各1例)
- ジセレカ100mgからのプラセボ切替え群:7例(潰瘍性大腸炎、急性B型肝炎、自己免疫性肝炎、冠動脈狭窄、ウイルス性胃腸炎、鉄欠乏性貧血、半月板損傷)
- プラセボ継続群:4例(急性腎障害、深部静脈血栓症、歯嚢胞、出血性梗塞、肺炎、過剰歯各1例)
投与中止に至った有害事象
寛解維持試験における投与中止に至った有害事象は、ジセレカ200mg群で3.5%(7/202例)、ジセレカ200mgからのプラセボ切替え群で2.0%(2/99例)、ジセレカ100mg群で5.6%(10/179例)、ジセレカ100mgからのプラセボ切替え群で4.4%(4/91例)、プラセボ継続群で3.2%(3/93例)に認められました。主な投与中止に至った有害事象は潰瘍性大腸炎で、ジセレカ200mg群で2例、ジセレカ200mgからのプラセボ切替え群で1例、ジセレカ100mg群で4例、ジセレカ100mgからのプラセボ切替え群で1例、プラセボ継続群で0例に認められました。
死亡に至った有害事象
寛解維持試験において死亡はジセレカ200mg群の1.0%(2/202例:左室不全、喘息各1例)に認められました。
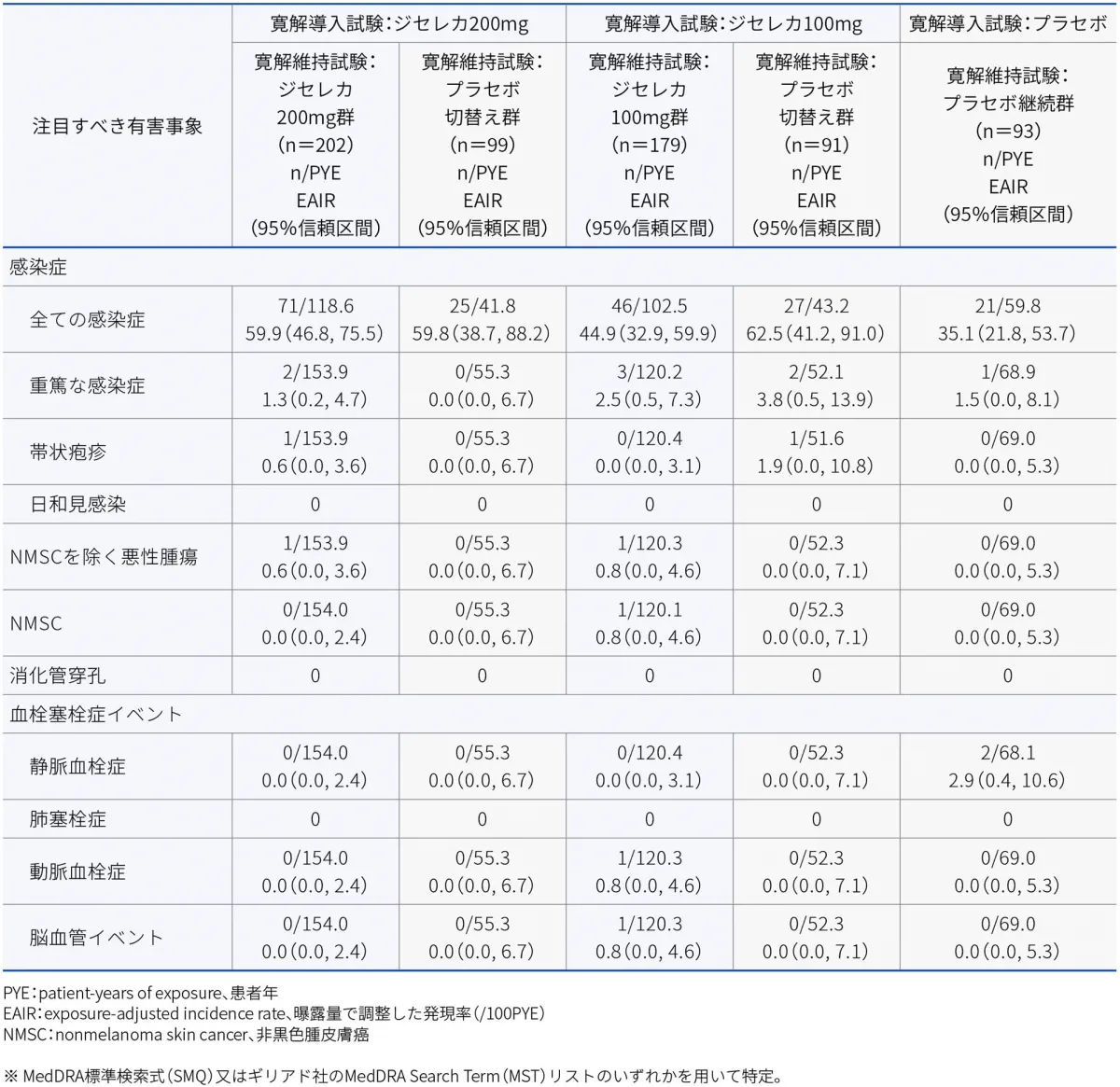
注目すべき有害事象
注目すべき有害事象として、既承認のJAK阻害剤との関連性が示唆されている次の有害事象を事前に規定し、安全性事象の発現状況を検討するため、包括的解析を実施しました。感染症(全ての感染症、重篤な感染症、帯状疱疹及び日和見感染)、消化管穿孔、NMSCを除く悪性腫瘍、NMSC及び血栓塞栓症イベント(静脈血栓症、肺塞栓症、動脈血栓症及び脳血管イベント)
注目すべき有害事象※