安全性
<Biologic-Naïve>
■有害事象の概要(安全性解析対象集団)
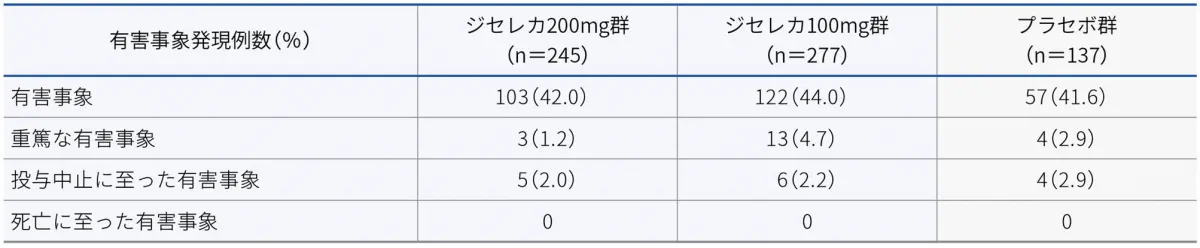
有害事象
Biologic-Naïveの寛解導入試験における有害事象は、ジセレカ200mg群で42.0%(103/245例)、ジセレカ100mg群で44.0%(122/277例)、プラセボ群で41.6%(57/137例)に認められました。主な有害事象は以下のとおりでした。
- ジセレカ200mg群:頭痛11例(4.5%)、悪心8例(3.3%)及び上咽頭炎7例(2.9%)
- ジセレカ100mg群:頭痛12例(4.3%)、貧血11例(4.0%)及び上咽頭炎9例(3.2%)
- プラセボ群:潰瘍性大腸炎7例(5.1%)、頭痛6例(4.4%)及び貧血5例(3.6%)
重篤な有害事象
Biologic-Naïveの寛解導入試験における重篤な有害事象は、ジセレカ200mg群で1.2%(3/245例)、ジセレカ100mg群で4.7%(13/277例)、プラセボ群で2.9%(4/137例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:3例(デング熱、胃腸出血、心膜炎各1例)
- ジセレカ100mg群:13例(潰瘍性大腸炎3例、貧血、虫垂炎、胃腸炎、高血圧、鉄欠乏性貧血、卵巣嚢胞破裂、汎血球減少症、交通事故、1型過敏症、嘔吐各1例)
- プラセボ群:4例(潰瘍性大腸炎3例、貧血、蜂巣炎、骨髄炎、処置による腸管穿孔各1例)
投与中止に至った有害事象
Biologic-Naïveの寛解導入試験における投与中止に至った有害事象は、ジセレカ200mg群で2.0%(5/245例)、ジセレカ100mg群で2.2%(6/277例)、プラセボ群で2.9%(4/137例)に認められました。主な投与中止に至った有害事象は潰瘍性大腸炎で、ジセレカ200mg群で1例、ジセレカ100mg群で2例、プラセボ群で2例に認められました。
死亡に至った有害事象
Biologic-Naïveの寛解導入試験において、死亡例は認められませんでした。
<Biologic-Experienced>
■有害事象の概要(安全性解析対象集団)
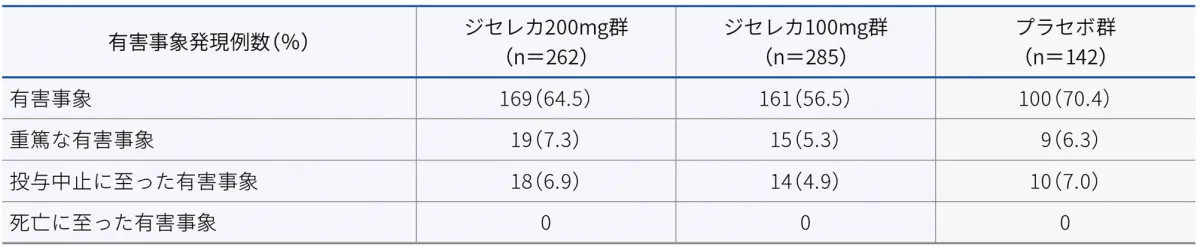
有害事象
Biologic-Experiencedの寛解導入試験における有害事象は、ジセレカ200mg群で64.5%(169/262例)、ジセレカ100mg群で56.5%(161/285例)、プラセボ群で70.4%(100/142例)に認められました。主な有害事象は以下のとおりでした。
- ジセレカ200mg群:潰瘍性大腸炎21例(8.0%)、上咽頭炎20例(7.6%)及び頭痛19例(7.3%)
- ジセレカ100mg群:上咽頭炎20例(7.0%)、悪心16例(5.6%)及び潰瘍性大腸炎15例(5.3%)
- プラセボ群:潰瘍性大腸炎11例(7.7%)、上咽頭炎11例(7.7%)、貧血10例(7.0%)、腹痛9例(6.3%)及び頭痛9例(6.3%)
重篤な有害事象
Biologic-Experiencedの寛解導入試験における重篤な有害事象は、ジセレカ200mg群で7.3%(19/262例)、ジセレカ100mg群で5.3%(15/285例)、プラセボ群で6.3%(9/142例)に認められました。重篤な有害事象は以下のとおりでした。
- ジセレカ200mg群:19例(潰瘍性大腸炎7例、椎間板突出2例、貧血、ウイルス性胃腸炎、腹痛、裂肛、虫垂粘液嚢胞、乳癌、クロストリジウム・ディフィシレ感染、出血性十二指腸潰瘍、鉄欠乏性貧血、大腸出血、腎結石症、肺塞栓症各1例)
- ジセレカ100mg群:15例(潰瘍性大腸炎5例、敗血症2例、貧血、肛門膿瘍、胸痛、異所性妊娠、大腿骨骨折、胃炎、頭痛、筋肉痛、悪心、ブドウ球菌感染、嘔吐各1例)
- プラセボ群:9例(潰瘍性大腸炎5例、ウイルス性胃腸炎、カンピロバクター胃腸炎、脳血管発作、喀血、急性膵炎、腎仙痛各1例)
投与中止に至った有害事象
Biologic-Experiencedの寛解導入試験における投与中止に至った有害事象は、ジセレカ200mg群で6.9%(18/262例)、ジセレカ100mg群で4.9%(14/285例)、プラセボ群で7.0%(10/142例)に認められました。
主な投与中止に至った有害事象は潰瘍性大腸炎で、ジセレカ200mg群で9例、ジセレカ100mg群で7例、プラセボ群で5例に認められました。
死亡に至った有害事象
Biologic-Experiencedの寛解導入試験において、死亡例は認められませんでした。
<Biologic-Naïve及びBiologic-Experiencedの併合>
注目すべき有害事象
注目すべき有害事象として、既承認のJAK阻害剤との関連性が示唆されている次の有害事象を事前に規定し、安全性事象の発現状況を検討するため、包括的解析を実施しました。
感染症(全ての感染症、重篤な感染症、帯状疱疹及び日和見感染)、消化管穿孔、NMSCを除く悪性腫瘍、NMSC及び血栓塞栓症イベント(静脈血栓症、肺塞栓症、動脈血栓症及び脳血管イベント)
■注目すべき有害事象※
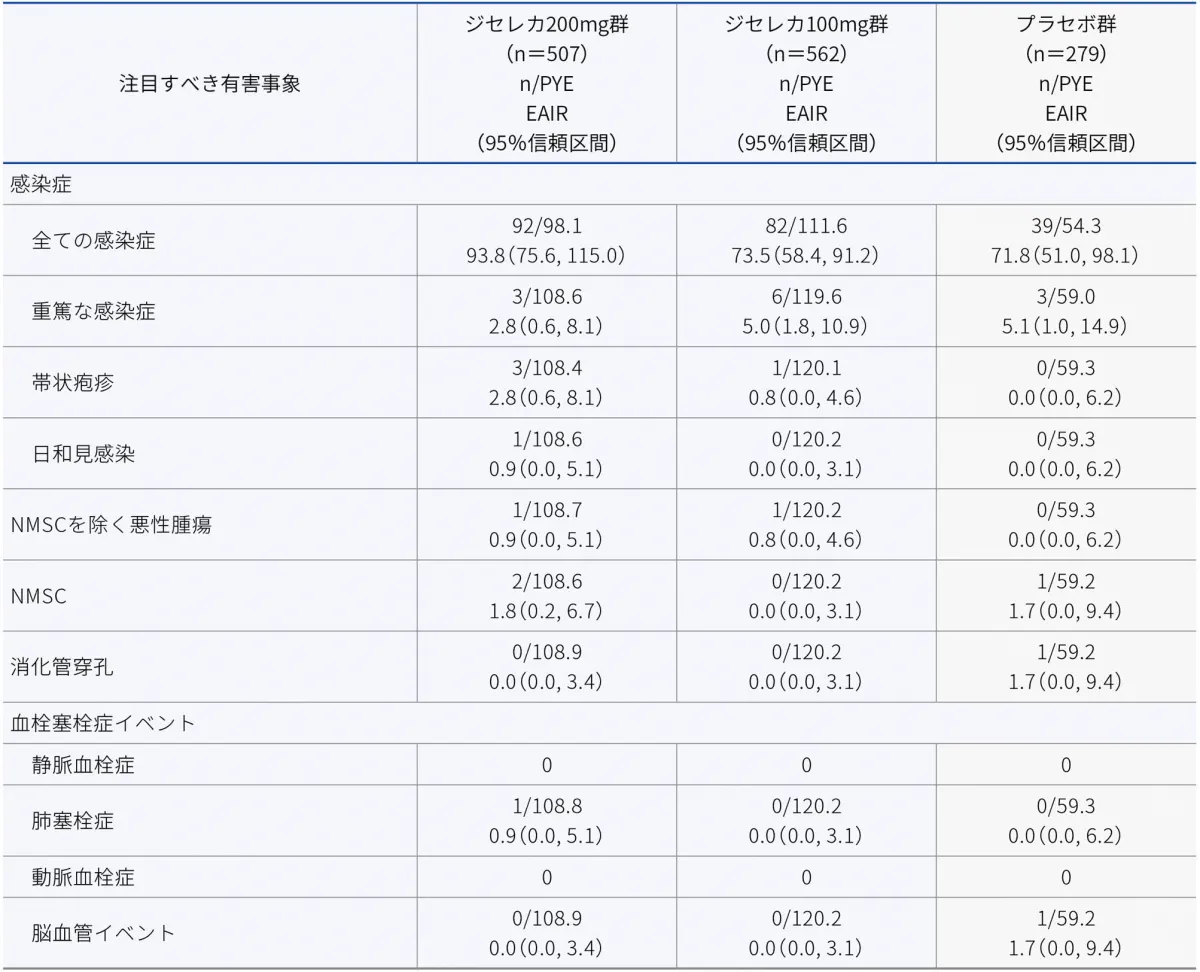
PYE:patient-years of exposure、患者年
EAIR:exposure-adjusted incidence rate、曝露量で調整した発現率(/100PYE)
NMSC:nonmelanoma skin cancer、非黒色腫皮膚癌
※ MedDRA標準検索式(SMQ)又はギリアド社のMedDRA Search Term(MST)リストのいずれかを用いて特定。






