試験概要:中等症から重症の活動性潰瘍性大腸炎患者における国際共同第Ⅱb/Ⅲ相試験(SELECTION試験)寛解維持期
社内資料:SELECTION(2022年3月承認)〔承認時評価資料〕
Feagan BG, et al. Lancet. 397(10292):2372 - 2384, 2021
利益相反:本研究はGilead Sciences Inc. の資金提供により行われた。
目的
中等症から重症の活動性潰瘍性大腸炎患者に対する寛解導入療法及び維持療法におけるジセレカの有効性及び安全性を評価する。
対象
中等症から重症の活動性潰瘍性大腸炎患者
- 寛解維持試験:664例(うち日本人54例)
主な選択基準
<寛解維持試験の主な適格性基準>
- Biologic-Naïve又はBiologic-Experiencedの寛解導入試験を完了し、Week 10の評価時点で臨床的改善(MCS改善)又は臨床的寛解(EBS寛解)を達成した患者
試験デザイン
ランダム化、二重盲検、プラセボ対照、統合第Ⅱb/Ⅲ相試験
方法
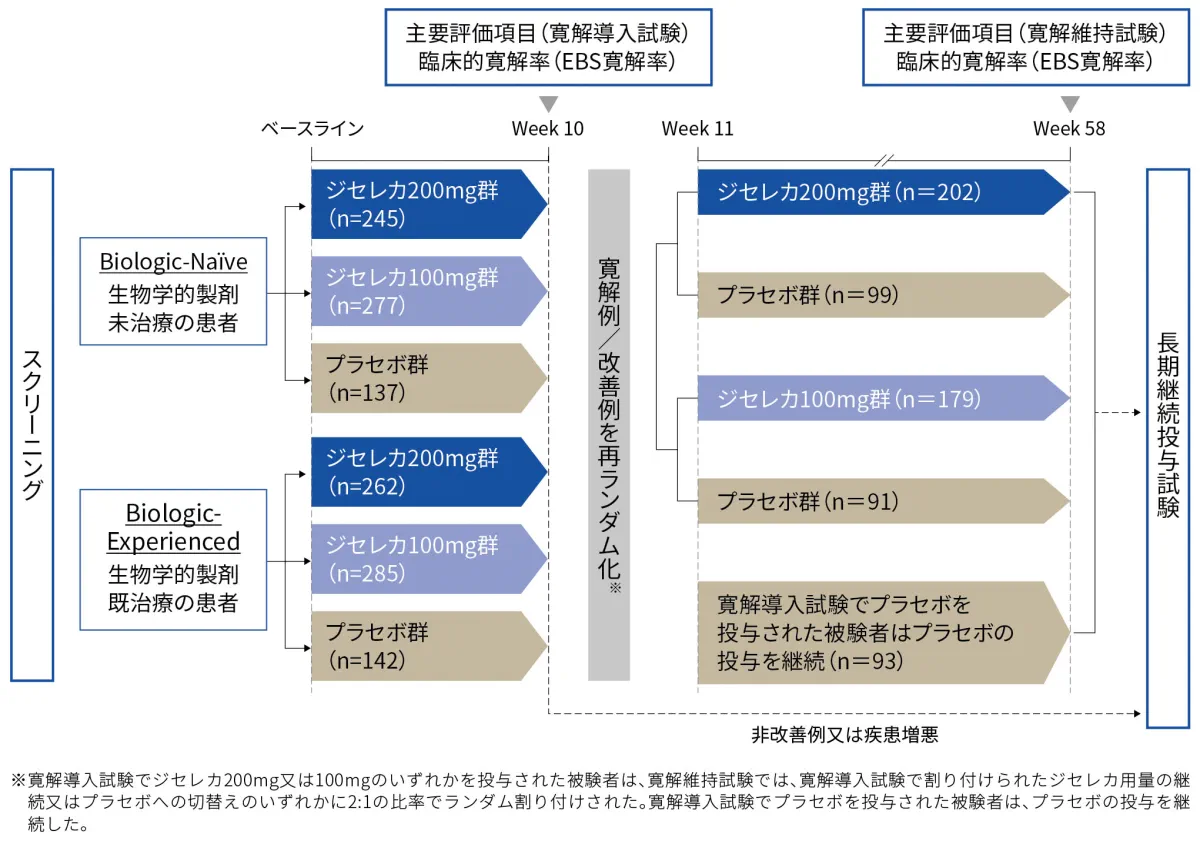
<寛解維持試験(Week 11~Week 58)>
Biologic-Naïve又はBiologic-Experiencedの寛解導入試験を完了し、Week 10時点で臨床的寛解(EBS寛解)又は臨床的改善(MCS改善)のいずれかを達成した被験者は、Week 11時点で再ランダム割り付けされ、寛解維持試験に移行した。寛解維持試験の被験者は、以下の因子により層別化した。
- 寛解導入試験での参加コホート(Biologic-Naïve又はBiologic-Experienced)
- Day 1時点での全身性経口ステロイド剤(プレドニゾン※2など)の併用の有無
- Day 1時点での免疫調節剤(6-MP※1、アザチオプリン、MTX※1など)の併用の有無
寛解導入試験でジセレカ200mg又は100mgのいずれかを投与された被験者は、寛解維持試験では、寛解導入試験で割り付けられたジセレカ用量の継続又はプラセボへの切替えのいずれかに2:1の比率でランダム割り付けされた。寛解導入試験でプラセボを投与された被験者は、プラセボの投与を継続した。ステロイド剤を併用していた被験者では、Week 14からステロイド剤の漸減療法を開始した※4。
<有効性評価項目>
主要評価項目(検証的評価項目)
- Week 58時点での臨床的寛解率(EBS寛解率)
副次評価項目
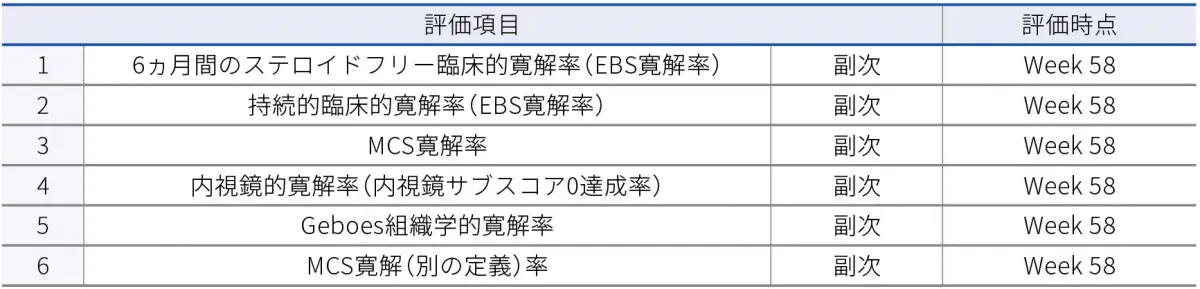
- Week 58時点での6ヵ月間のステロイドフリー臨床的寛解率(EBS寛解率)
- Week 58時点での持続的臨床的寛解率(EBS寛解率)
- Week 58時点でのMCS寛解率
- Week 58時点での内視鏡的寛解率(内視鏡サブスコア0達成率)
- Week 58時点でのGeboes組織学的寛解率
- Week 58時点でのMCS寛解(別の定義)率
探索的評価項目
- Week 58時点での内視鏡的改善率(内視鏡サブスコア0又は1達成率)
- Week 58時点での臨床的改善率(MCS改善率)
- Week 58時点での臨床的寛解(EBS寛解)(別の定義)率
- 各来院時での部分MCSのベースラインからの変化量
- 各来院時での健康関連QOLスコアのベースラインからの変化量
- 各来院時でのバイオマーカーのベースラインからの変化量
<安全性評価項目>
- 有害事象(寛解導入試験、寛解維持試験)
- 注目すべき有害事象として、既承認のJAK阻害剤との関連性が示唆されている次の有害事象を事前に規定し、安全性事象の発現状況を検討するため、包括的解析を実施した。:感染症(全ての感染症、重篤な感染症、帯状疱疹及び日和見感染)、消化管穿孔、NMSCを除く悪性腫瘍、NMSC及び血栓塞栓症イベント(静脈血栓症、肺塞栓症、動脈血栓症及び脳血管イベント)
解析計画
<解析対象集団>
有効性の主要解析は最大の解析対象集団(FAS)を対象として実施した。
なお、Biologic-Experienced寛解導入試験の日本国内での申請を目的とした主たる解析(Japan specific analysis)は、医薬品医療機器総合機構(PMDA)からの助言に従って実施した。すなわち、ジセレカ200mg群の有効性をプラセボ群と比較する主要解析は、プラセボ群に含まれる米国/韓国のdualrefractory(TNFα阻害剤及びベドリズマブの両剤で治療不成功)ではない男性被験者を除外したFASを対象として行った。
ジセレカ200mg群の有効性に関する副次解析及びジセレカ100mg群の有効性に関する主要/副次解析は、全てのFASを対象として行った(Global analysis)。
<寛解維持試験(Week 11~Week 58)>
寛解維持試験のFASは、寛解導入試験のジセレカ200mg群又は100mg群でWeek 10時点に臨床的寛解(EBS寛解)又は臨床的改善(MCS改善)を達成し、再ランダム化後の寛解維持試験で治験薬を少なくとも1回投与された全ての被験者とした。寛解維持試験では、ジセレカ200mg群とプラセボ群及びジセレカ100mg群とプラセボ群での治療効果をCMH検定※6により比較した。寛解維持試験では中間解析を設定しなかったため、最終的な主要解析でのジセレカ各群とプラセボ群との比較検定は有意水準(両側)0.025で実施された。
寛解維持試験の主要解析で、ジセレカ200mg又は100mgのプラセボに対する優越性が検証された場合には、引き続きジセレカの同用量群について、以下の順序により主な副次仮説(ジセレカ群とプラセボ群で同等である)に関する検定を同じ有意水準で実施した。
寛解維持試験では、寛解導入試験と同じ手法で有意水準(両側)0.025によりジセレカ各群とプラセボ群を比較した。
また、寛解導入試験、寛解維持試験ともに日本人集団における有効性について、サブグループ解析を実施した。
EBS:endoscopy/bleeding/stool frequency、内視鏡所見/直腸出血/排便回数
MCS:Mayo Clinic Score、Mayoスコア
※1:潰瘍性大腸炎に対しては国内未承認
※2:国内未承認
※3:TNFα阻害剤及びベドリズマブの両剤で治療不成功
※4:ステロイド剤は、プレドニゾン※2換算で1週間ごとに2.5㎎~5㎎ずつ、ステロイドフリーに至るまで漸減した。ブデソニドの場合は、3週間ごとに3mg/日ずつ漸減した。
※5:層別因子は、Biologic-Naïve寛解導入試験ではDay 1時点の全身性経口ステロイド剤の併用の有無及びDay 1時点の免疫調節剤の併用の有無、Biologic-Experienced寛解導入試験ではDay 1時点の全身性経口ステロイド剤の併用の有無、Day 1時点の免疫調節剤の併用の有無及び生物学的製剤による前治療歴(1種類又は2種類以上)とした。
※6:層別因子は、寛解導入試験での参加コホート(Biologic-Naïve又はBiologic-Experienced)、寛解維持試験のベースライン時点の全身性経口ステロイド剤の併用の有無及び寛解維持試験のベースライン時点の免疫調節剤の併用の有無とした。
■中等症から重症の活動性潰瘍性大腸炎患者における国際共同第Ⅱb/Ⅲ相試験:試験デザイン
■患者背景(安全性解析対象集団)
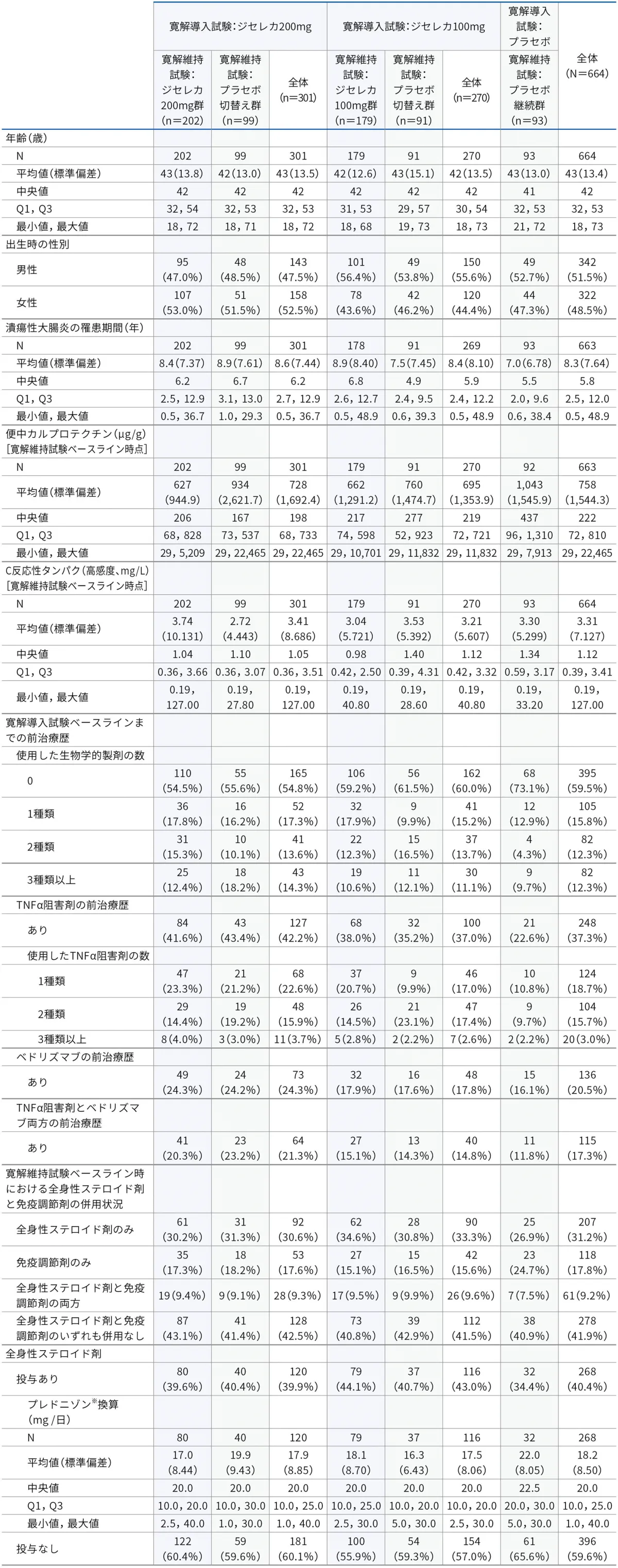
Q1:第1四分位
Q3:第3四分位
年齢:寛解導入試験において最初に治験薬を投与された時点での年齢
潰瘍性大腸炎の罹患期間:寛解導入試験ベースライン時点までの期間
生物学的製剤の治療歴:潰瘍性大腸炎に対し承認されている薬剤のみ集計
全身性ステロイド剤:投与経路が経口、静注、筋注の薬剤のみ集計
※:国内未承認






